
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы связей между атомами
|
|
|
|
Электроны в периодическом поле кристалла. Модель Кронига - Пенни. Образование энергетических зон для электронов в кристалле. Зонная структура в металлах, полупроводниках и диэлектриках. Проводимость металлов. Сверхпроводимость.
Ионная связь между атомами разных химических элементов существует в том случае, когда атом одного элемента забирает валентные электроны у атома другого элемента. При этом электронные конфигурации образовавшихся ионов обладают устойчивостью. Например, одновалентный натрий отдаёт электрон со своей внешней оболочки семивалентному хлору. Ион натрия с положительным зарядом обладает устойчивостью, т.к. для последующей его ионизации требуется значительная энергия. Образовавшийся отрицательный ион хлора на внешней оболочке имеет 8 электронов и эта оболочка полностью заполнена. Обе конфигурации обладают устойчивостью. Но два иона притягиваются электростатическими силами, образуя молекулу поваренной соли NaCl. Эта молекула, являясь электрическим диполем, взаимодействует с другими подобными молекулами, в результате чего образуется кристалл соли.
Возможен тип связи, при которой между молекулами возникают так называемые силы Ван-дер-Ваальса. Эти силы можно охарактеризовать как усреднение взаимодействия между полярными молекулами. Такой тип связи наблюдается, например, у кристаллических Н2,  , СН4 и т.д.
, СН4 и т.д.
Ковалентная связь образуется в случае, когда два атома постоянно обмениваются двумя валентными электронами с противоположно направленными спинами. В результате такого обмена каждый из электронов одновременно находится в каждом из атомов. Такой тип связи, например, у атомов решётки алмаза, германия.
Возможно образование такой связи между атомами, при которой все атомы объединяют свои валентные электроны. Т.е. валентные электроны одновременно принадлежат всем атомам и поэтому свободно могут перемещаться от одного атома к другому. Такие электроны называют свободными, а такой тип связи – металлическим типом связи. Оказывается, что для атомов типичных металлов металлический тип связи между одинаковыми атомами энергетически более выгоден (при обычных условиях) в случае, когда они располагаются в структуры с пространственной симметрией. Как говорят, атомы образуют кристаллическую решетку, обладающую определённой пространственной симметрией.
Особая металлическая связь является специфическим видом химической связи и возникает между ионами кристаллической решётки и электронным газом. Электроны «стягивают» положительные ионы (главным образом электростатическими силами) и уравновешивают отталкивание между ними. При расстояниях между ними, равных периоду кристаллической решётки, образуется устойчивое состояние металлического кристалла. В узлах кристаллической решётки в строгом порядке расположены положительные ионы, потенциальная энергия электрона изменяется вдоль некоторого направления OX так, как показано ниже на рисунке (стр.2).
Периодическое электрическое поле в кристалле любого типа существенно изменяет энергетические состояния электронов в твёрдом теле по сравнению с их состоянием в изолированных атомах. В изолированных атомах электроны находятся в дискретных энергетических состояниях. В твёрдом теле энергетические состояния электронов определяются как взаимодействием их с ядром своего атома, так и электрическим полем кристаллической решётки, т.е. взаимодействием с другими атомами. В результате этого взаимодействия энергетические уровни электронов расщепляются. Вместо дискретного энергетического уровня, характерного для изолированного атома, в твёрдом теле, содержащем N взаимодействующих атомов, возникает N близко расположенных друг от друга энергетических уровней, которые образуют энергетическую зону.
Итак, если общее число атомов твёрдого тела равно N, то энергетическая зона, образовавшаяся из электронного энергетического уровня валентного электрона атома, состоит из N близко расположенных друг к другу уровней. Соседние энергетические уровни в зоне отстоят друг от друга приблизительно на 1/ N эВ.
Рассмотрим одномерную модель кристалла, в которой кристалл состоит из одинаковых атомов, расположенных вдоль одной прямой линии. Уравнение Шрёдингера для стационарного состояния:
 .
.
Предположим, что потенциальная энергия является периодической функцией с периодом a, т.е. 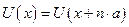 , где n – целое число. Тогда плотность вероятности тоже должна быть периодической функцией:
, где n – целое число. Тогда плотность вероятности тоже должна быть периодической функцией:  .
.
Метод Блоха состоит в том, что пси-функцию записываем в виде: 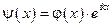 , где
, где  - периодическая функция. Т.е. волновая функция в соседних ячейках кристалла отличается фазовым множителем:
- периодическая функция. Т.е. волновая функция в соседних ячейках кристалла отличается фазовым множителем:
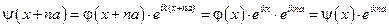 .
.
Поэтому для поиска функции  достаточно рассмотреть одну ячейку кристалла.
достаточно рассмотреть одну ячейку кристалла.
Т.к. 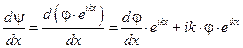 и
и  , то уравнение Шрёдингера примет вид (после сокращения на множитель
, то уравнение Шрёдингера примет вид (после сокращения на множитель 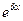 ):
):
 .
.
Вводим обозначение: 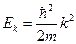 и переписываем уравнение в виде:
и переписываем уравнение в виде:
 .
.

|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 613; Нарушение авторских прав?; Мы поможем в написании вашей работы!