
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграммы состояния II рода
Диаграммами состояния II рода называются диаграммы состояния сплавов, компоненты которых неограниченно растворимы друг в друге в жидком и твердом состоянии. При кристаллизации такие сплавы образуют твердые растворы – это твердые фазы, в которых атомы одного компонента (растворимый элемент) располагаются в кристаллической решетке другого (растворитель) без образования молекул определенного состава. Состав твердых растворов непостоянен и зависит от температуры и концентрации. Характерной особенностью твердых растворов является наличие в их кристаллической решетке разнородных атомов при сохранении типа решетки растворителя.
По степени растворимости компонентов различают твердые растворы:
- с неограниченной растворимостью компонентов,
- с ограниченной растворимостью компонентов.
Неограниченная растворимость возможна только в случае твердых растворов типа замещения. В случае неограниченной растворимости компонентов кристаллическая решетка растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента.
Условием образования твердых растворов с неограниченной растворимостью является:
1) изоморфность (однотипность) кристаллических решеток компонентов;
2) близкий размер атомных радиусов компонентов (не должны отличаться более чем на 8–13 %);
3) близость физико-химических свойств подобных по строению валентных оболочек атомов.
При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела. При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси.
По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы: замещения, внедрения, вычитания.
В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента (рис. 4, а). Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами. При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются. В первом приближении это изменение пропорционально концентрации растворенного компонента. Изменение параметров решетки при образовании твердых растворов – важный момент, определяющий изменение свойств. Уменьшение параметра ведет к большему упрочнению, чем его увеличение.

|
| Рис. 4. Типы твердых растворов: а – замещения на основе компонента А; б – внедрения на основе компонента А; в – химическое соединение из компонентов А и В – растворитель; г – вычитания на основе химического соединения; д – замещения на основе химического соединения |
Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры (междоузлия) кристаллической решетки растворителя (рис. 4, б). Условием образования таких растворов являются малые размеры атомов растворенного элемента. Радиус атомов элементов должен быть соизмерим с размерами междоузлий или меньше их. Небольшие размеры атомов имеют элементы, находящиеся в начале периодической системы Менделеева: углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла. Это вызывает искажение решетки, и в ней возникают напряжения.
Твердые растворы вычитания, или растворы с дефектной решеткой, образуются на основе химического соединения, когда один из элементов, образующих соединение, присутствует в соотношении, превышающем стехиометрическое (формульное) (рис. 4, в и г). В этом случае атомы одного из элементов, входящих в формулу (излишек которого имеется), занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются незанятыми. Также возможно образование твердых растворов замещения на основе химического соединения, оно будет являться растворителем (4, д).
Для сплавов, образующих при кристаллизации твердые растворы, характерно следующее:
- компоненты сплавляются в любом процентном соотношении;
- кристаллическая решетка твердого раствора сохраняет тип решетки одного из компонентов, который по этому признаку считается растворителем;
- физико-механические свойства сплавов данной системы не являются средней арифметической свойств сплавляемых компонентов.
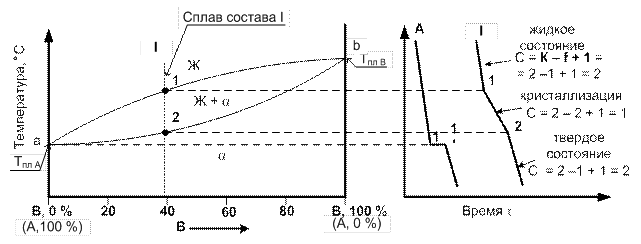
Общий вид диаграммы состояния II рода и кривые охлаждения типичных сплавов системы представлены на рис. 5.
 а б а б
|
| Рис. 5. Диаграмма состояния двойного сплава II рода (а) и кривые охлаждения типичных сплавов системы (б) |
Проведем анализ диаграммы состояния:
Количество компонентов: К = 2 (компоненты А и В).
Число фаз: f = 2 (кристаллы твердого раствора a, жидкая фаза Ж).
Линия a1b является линией ликвидус. Линия a2b является линий солидус. На линии a1b при охлаждении начинают выделяться кристаллы твердого раствора a. На линии a2b при охлаждении заканчивается выделение кристаллов твердого раствора a.
Кристаллизация сплавов рассматриваемой диаграммы состояния:
Чистые компоненты А и В кристаллизуются при постоянной температуре, на рис 5, б показана кривая охлаждения компонента А.
На диаграммах состояния I рода все сплавы системы кристаллизуются однотипно. Рассмотрим кристаллизацию сплава I, кривая охлаждения которого представлена на рис. 5, б.
Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. Число степеней свободы для этого участка С = 2. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора a. На кривой охлаждения отмечается перегиб (критическая точка 1), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 при понижающейся температуре идет процесс кристаллизации, число степеней свободы будет равно единице (С = 2 – 2 + 1 = 1). При охлаждении химический состав жидкой фазы изменяется по линии a1b, состав твердой фазы – по линии a2b. Кристаллизация заканчивается при температуре, соответствующей точке 2. На кривой охлаждения отмечается перегиб (критическая точка 2), связанный с увеличением скорости охлаждения вследствие прекращения выделения скрытой теплоты кристаллизации. Ниже точки 2 происходит охлаждение сплава в твердом состоянии, состоящего из кристаллов твердого раствора a. Число степеней свободы ниже точки 2 соответствует двум (С = 2 – 1 + 1 = 2).
Количественный структурно-фазовый анализ сплава аналогичен рассмотренному ранее.
Микроструктура твердых растворов после кристаллизации представлена однородными зернами и соответствует структуре компонента растворителя. Компоненты, составляющие сплав, в данном случае будут неразличимы в микроскоп. Сплавы, структура которых представлена твердыми растворами, пригодны для обработки давлением, ковки.
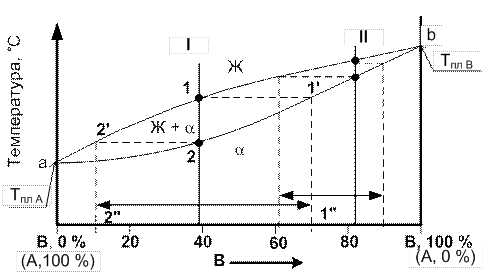
Дендритная ликвация. Для сплавов, образующих твердые растворы и имеющих широкий интервал кристаллизации, характерно явление дендритной ликвации. Сущность ее заключается в разном химическом составе первых выделившихся из жидкой фазы кристаллов (первичных осей дендритов, центральной части кристаллов) и кристаллов, закристаллизовавшихся из последних объемов жидкой фазы (вторичных и последующих осей дендритов, периферийной части кристаллов, междендритного пространства). При кристаллизации сплава I (рис. 6) первые кристаллы, выделившиеся из жидкой фазы, имеют состав, соответствующий проекции точки 1 на линию солидус 1″: 19 % А и 81 % В. В конце процесса кристаллизации состав образующихся кристаллов соответствует составу оставшейся жидкой фазы – проекции точки 2 на линию ликвидус 2″: 93 % А и 7 % В. Из этого следует, что центральная часть кристаллов обогащена более тугоплавким компонентом В, а периферийная часть более легкоплавким компонетом А.
|
| Рис. 6. Графическое пояснение дендритной ликвации в сплавах |
В процессе охлаждения и роста состав центральной части кристалла непрерывно обогащается металлом А в связи с диффузией его атомов из жидкости. В момент окончания затвердевания при t2 состав кристалла в целом будет равен составу сплава, т. е. содержит 39 % В.
В реальных условиях охлаждения выравнивающая состав диффузия полностью не проходит, поэтому центральные части кристалла оказываются обогащенными более тугоплавким металлом В, а периферийные части богаты металлом А.
Оценив интервал кристаллизации сплава, можно предположить, имеет ли сплав склонность к дендритной ликвации. При сравнении интервалов кристаллизации сплавов I и II (рис. 6) следует, что склонность к дендритной ликвации выше у сплава I.
|
Дата добавления: 2014-01-07; Просмотров: 2590; Нарушение авторских прав?; Мы поможем в написании вашей работы!