
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 12. Равновесия в насыщенных растворах Расчёт растворимости веществ. Произведение растворимости
|
|
|
|
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. При заданных условиях концентрация насыщенного раствора не изменяется во времени. Её называют растворимостью и обозначают заглавной буквой английского термина « Solubility » S. Растворимость зависит от температуры и состава раствора. Обычно её рассчитывают на основе термодинамических констант. Рассмотрим равновесие между солью, состоящей из катионов металла Mz + и анионов кислотного остатка Az -, и её насыщенным раствором. При этом учтем, что все соли - сильные электролиты, полностью диссоциирующие в растворе.
Мn + Аn-(т) Û n+Мz+(р-р) + n-Аz-(р-р). (49)
Константу данного равновесия называют произведением растворимости соли и обозначают L. Запишем её выражение согласно закону действующих масс учитывая, что активность чистого растворенного вещества равна 1 (стандартное состояние).
L = a +n+× a -n- = [Mz+]n+×[Az-]n-×g±n, (50)
где n = n+ + n-, а среднеионный коэффициент активности g± = (g+n+×g-n-)1/n. Выражение (50) используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости берут в справочнике или вычисляют по величине энергии Гиббса растворения соли:
 (51)
(51)
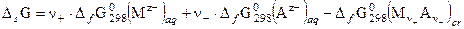 (52)
(52)
а) Растворимость в бинарной системе соль - вода.
В этом случае, согласно уравнению (49),
[Mz+] = n+S и [Az-] = n-S.
Подставим эти соотношения в (50).
L = (n+S)n+(n-S)n-×g±n.
После преобразования получим:
L = (n±g±S)n,
где среднеионный стехиометрический коэффициент равен:
n± = (n+n+×n-n-)1/n, а n+ + n- = n.
Отсюда получаем формулу для расчета растворимости соли в воде:
 (53)
(53)
Если растворимость соли ниже 10-4 моль/л, то среднеионный коэффициент активности можно принять равным 1.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 377; Нарушение авторских прав?; Мы поможем в написании вашей работы!