
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дипольный момент
|
|
|
|
Таким образом, полярность связи можно оценить, исходя из ее дипольного момента. Однако измерить можно только дипольный момент молекулы, являющийся в общем случае векторной суммой моментов связей и свободных электронных пар.
mмол = ē·l
где l – расстояние между центрами тяжести положительных и отрицательных зарядов молекулы.
Грубо говоря, индивидуальные моменты связей одинаковы в разных молекулах, хотя они и не всегда постоянны.
Таблица 8
Дипольные моменты связей
| Связь | H–C | H–N | C–O | С–S | C–N | C–F | C–Cl | C–Br | C–I |
| m, D | 0,2 | 1,4 | 1,1 | 1.56 | 0,4 | 1,83 | 2,05 | 2,04 | 1,8 |
Из сравнения дипольных моментов связей следует, что полярность связи тем больше, чем больше разность электроотрицательностей образующих связь атомов.
Исключение составляют связи C–O и C–S, C–F и C–Cl из-за сильного увеличения длины связи при переходе от элементов 2-го к элементам 3-го периода:
C–O C–S C–F C–Cl
1,1D < 1,56D 1,83D < 2,05D
Дипольные моменты кратных связей больше, чем соответствующих ординарных:
Таблица 9
Дипольные моменты кратных связей
| Связь | C–O | C=O | C–N | CºN |
| m, D | 1,1 | 2,5 | 0,4 | 3,3 |
Вывод о направлении дипольного момента можно сделать, исходя из данных по электроотрицательности атомов–компонентов связи: атом, имеющий меньшую электроотрицательность, является положительным концом диполя. Однако для сопряженных (ароматических) систем это правило соблюдается не всегда.
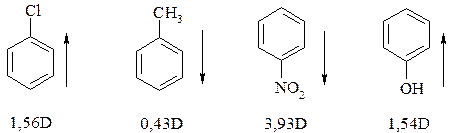
Значение дипольного момента в направлении линии связи можно использовать для сравнительной качественной оценки полярности связей (относительной полярности).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 774; Нарушение авторских прав?; Мы поможем в написании вашей работы!