
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы неэлектролитов
|
|
|
|
По термодинамическому признаку растворы делятся на идеальные и реальные. Для идеальных растворов предполагается, что между компонентами раствора любыми взаимодействиями можно пренебречь. Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Рауля будет аддитивной величиной:
Р = РБ+РТ = Р0Б cБ + Р0Т cТ
Здесь Р0Б и cБ, Р0Т и cТ – соответственно давление и мольные доли бензола и толуола.
Если раствор сохраняет свойства идеальности при любых концентрациях, его называют идеальным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ→0. Во всех прочих случаях раствор считается реальным.
Взаимодействие между компонентами раствора, выражаемое через энтальпию сольватации ΔHсольв, служит в определенных пределах мерой идеальности раствора. Д. И. Менделеев показал, что взаимодействие между компонентами раствора может рассматриваться как химический процесс образования соединений переменного состава – сольватов. Если при кристаллизации твердая фаза содержит молекулы растворителя, то ее называют кристаллосольватом.
ЗАКОН ГЕНРИ
Если растворенное вещество характеризуется большой упругостью пара, по сравнению с упругостью пара растворителя (PB >> PA), и при этом оба компонента раствора химически инертны, то растворение такого газообразного вещества в жидкости подчиняется закону Генри: при постоянной температуре давление летучего (газообразного) компонента PB прямо пропорционально его мольной доле χB:
РВ = КН χB (11.1)
где KH – константа Генри.

|
| Рисунок 11.1 Зависимость давления пара над смесью бензол–толуол от мольной доли компонентов. |
В табл. 11.3 приведены константы Генри некоторых газов для воды.
Таблица 11.3
Константы Генри для воды при 298 K
|
Из уравнения (11.1) следует, что KH определяется выбором единиц давления и концентрации.
ЗАКОНЫ РАУЛЯ
Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
РА = Р0А χА
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества.
После подстановки χA = 1 – χB и несложных преобразований:
РА = Р0А- Р0А χВ
получаем:

Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента.
Из этого закона можно вывести два следствия, которые в объединенном виде формируются как второй закон Рауля.

|
| Рисунок 11.2 Зависимость повышения температуры кипения ΔTкип и понижения температуры замерзания ΔTзам раствора от концентрации растворенного вещества. На рис. приведены зависимости P(T) чистого растворителя и двух его растворов P'(T) и P''(T). |
Выразим мольную долю χi через моляльную концентрацию CiCой возмутитель спокойствия российских граждан.ую тебя. мех. Поэтому давай вместе дружно посмеемся, и все пройдет. я по этому пm Для двухкомпонентного раствора χB = 1 - χА. При CiCой возмутитель спокойствия российских граждан.ую тебя. мех. Поэтому давай вместе дружно посмеемся, и все пройдет. я по этому пm << 1 получим:
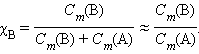
Из подобия треугольников следует:

По определению, при C”Cой возмутитель спокойствия российских граждан.ую тебя. мех. Поэтому давай вместе дружно посмеемся, и все пройдет. я по этому пm (B) = 1 моль∙кг-1 повышение температуры ΔT” равно Кэб – эбуллиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
ΔTК = КэбСm(B).
Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим
ΔTз = КкрСm(B),
где Kкр – криоскопическая константа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
ΔT = КСm(B)
В табл. 11.4 приведены Kкр и Kэб для воды и бензола.
Таблица 11.4
Криоскопические и эбуллиоскопические константы для воды и бензола (град∙моль–1∙кг).
|
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = g(B) ∙ 1000 / μ(B) ∙g(A), где g(A) – масса растворителя, g(B) – масса растворенного вещества, μ(B) – его молярная масса. Тогда из ΔT = Kкр · m получим молярную массу растворенного вещества:
μ(B)= КкрgB1000 / gA ΔTЗ.
ЛЕКЦИЯ 12
Осмотическое давление. Закон Вант-Гоффа. Свойства растворов электролитов. Причины отклонения свойств растворов электролитов и неэлектролитов. Изотонический коэффициент. Классификация электролитов по степени диссоциации. Слабые электролиты. Закон Оствальда.
ОСМОС
Если создать систему из двух растворов, разделенных мембраной, через которую способны проходить только молекулы растворителя, то свойства такой системы будут определяться разностью концентраций растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением.
C:\Documents and Settings\кафедра Химии\Program Files\Physicon\Open Chemistry 2.5\design\images\buttonModel_h.gif

|
| Рис. 12.1 Модель осмоса |
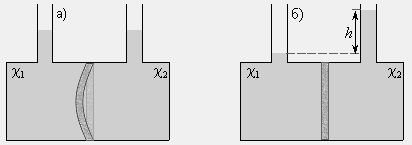
Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M (рис. 12.1). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя (χ) по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рис. 12.2а).
Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рис. 12.2б) не станет равным осмотическому давлению и не прекратит осмос.
|
| Рис. 12.2. Схема разности осмотических давлений при χ1 < χ2 при эластичной (а) и жесткой (б) мембранах. |
Осмотическое давление π – это внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа:
p ×V = R ×T
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде:
p =C×R×T
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм. (2,27 МПа).
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C(B) в формуле Вант-Гоффа соотношением (m(B) ∙ 1000 / μ(B) ∙ V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:

где m(B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул:
 (12.1)
(12.1)
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением

Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в водном растворе уксусная кислота диссоциирует CH3COOH = CH3COO– + H+, и число частиц становится больше числа молекул.
РАСТВОРЫ СЛАБЫХ ЭЛЕКТРОЛИТОВ
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. Ионизационный механизм состоит в том, что в молекулах газообразных, твердых и жидких веществ под воздействием полярных молекул растворителя увеличивается доля ионности настолько, что в раствор могут переходить сольватированные ионы. В зависимости от природы растворителя электролит может быть полностью диссоциирован, либо будет вести себя как слабый электролит:
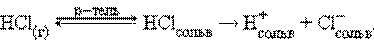
В воде равновесие смещено вправо, и растворенный хлористый водород диссоциирован полностью. В бензоле растворенный HCl ведет себя как слабый электролит.
Важной характеристикой электролитов служит степень диссоциации α:

По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α > 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
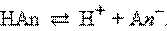
Константа равновесия Kc этой реакции и есть Kд:
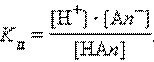
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим:

Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:

Тогда
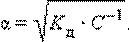
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда зависимость изотонического коэффициента от степени диссоциации можно записать в виде

Решая его относительно α, получим:
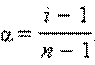
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
ЛЕКЦИЯ 13
Сильные электролиты. Активность. Электролитическая диссоциация воды. Водородный показатель. Ионные реакции в растворах. Гидролиз солей. Диссоциация комплексных соединений. Теория кислот и оснований.
ДИССОЦИАЦИЯ ВОДЫ
Важное значение в кислотно-основном равновесии растворенных в воде электролитов имеет диссоциация молекул растворителя.
Вода диссоциирует на ионы: Н2О «Н+ + ОН-, ее константа при 298 K равна:
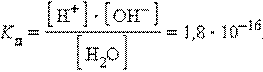
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной:

Отсюда произведение постоянных величин
Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
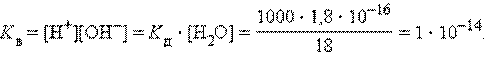
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде, и в этом случае [H+] = [OH–] = 1∙10–7, при [H+] > 1∙10–7 – кислой, при [H+] < 1∙10–7 – щелочной.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH) window.top.document.title = "6.4.1. Водородный показатель pH";
 Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH при C = 2 н. равен 14,3). На рис. 13.1 приведены pH некоторых бытовых растворов и пищевых продуктов.
РАСТВОРЫ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:

а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель постулировали:
1. Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
2. Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Очевидно, что при электростатическом взаимодействии ионов противоположных знаков необходимо учитывать влияние ионной атмосферы. При движении катиона в электростатическом поле ионная атмосфера деформируется; она сгущается перед ним и разрежается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящее действие движению катиона, чем выше концентрация электролитов и чем больше заряд ионов. В этих системах само понятие концентрации становится неоднозначным и должно заменяться активностью. Для бинарного одно-однозарядного электролита KatAn → Kat+ + An+ активности катиона (a+) и аниона (a–) соответственно равны

где C+ и C– – аналитические концентрации соответственно катиона и аниона, γ+ и γ– – их коэффициенты активности.
Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значений активностей и коэффициентов активностей:
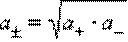

Коэффициент активности по Дебаю–Хюккелю зависит, по крайней мере, от температуры, диэлектрической проницаемости растворителя (ε) и ионной силы (I). Последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Для данного электролита ионная сила выражается уравнением Дебая–Хюккеля:

Ионная сила в свою очередь равна:
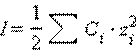
Здесь C – аналитическая концентрация, z – заряд катиона или аниона. Для одно-однозарядного электролита ионная сила совпадает с концентрацией.
Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будут иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита. Знание коэффициентов активностей позволяет оценить реальные свойства сильных электролитов.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА
ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель.
Кислоты, по определению Аррениуса, в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы. Но, в настоящее время, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятыми теориями кислотно-основного взаимодействия сейчас считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
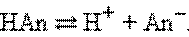
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
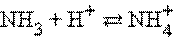
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.

|
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением


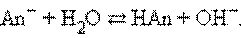

Перемножив константы сопряженных кислот и оснований, получим
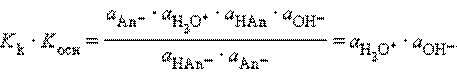
Заменив активности а (Н3О+) и а (ОН–)на равновесные концентрации, получим

Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным Kk (Kосн) можно легко найти значения сопряженных KВ.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, основанием называется вещество, способное присоединять электронную пару, а кислотой– вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары:NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи. Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.

|
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:

Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
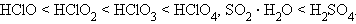
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:

Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:

При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
K1: K2: K3 = 1: 10–5: 10–10.
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме:

и для этой реакции

Прибавление к раствору уксусной кислоты ее соли (CH3COONa → CH3COO– + Na+) резко увеличивает концентрацию ионов CH3COO– и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [CH3COOH] = [кислота], и [CH3COO–] = [соль] концентрация H+ равна
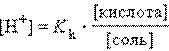
или
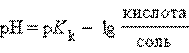
Следовательно, концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Рассуждая аналогичным образом, можно вывести уравнения для раствора слабого основания и его соли (NH4OH и NH4Cl):

или

Из предыдущих уравнений видно, что концентрация ионов водорода при разбавлении сохраняется, ибо отношения:
[кислота]: [соль], [соль]: [основание]
остаются постоянными. Добавление к такой смеси кислоты или щелочи приводит к связыванию избыточных ионов H+ анионами, а OH– – катионами. Это смещает равновесие диссоциации слабого электролита, в результате чего концентрация H+ практически не меняется. Растворы, содержащие смесь слабого электролита и его соли, сохраняющие характерные для него значения pH при разбавлении, добавлении сильных кислот или щелочей, называются буферными.
Однако буферные растворы сохраняют постоянство pH только до прибавления определенного количества сильной кислоты или щелочи, то есть буферные растворы обладают определенной «емкостью».
Буферная емкость определяется количеством эквивалентов сильной кислоты или основания, которые необходимо добавить к 1 л буферного раствора, чтобы изменить его pH на единицу.
Очевидно, чем более концентрированный буферный раствор, тем больше его буферная емкость.
ГИДРОЛИЗ СОЛЕЙ
В водных растворах соли полностью диссоциируют на катионы и анионы. Кроме них в растворе есть ионы H+ и OH–, образующиеся вследствие диссоциации молекул воды. Если эти ионы при взаимодействии с ионами соли образуют плохо диссоциирующие соединения, то идет гидролиз соли – разложение соли водой с образованием слабого электролита. Возможность и характер протекания гидролиза определяется природой соли:
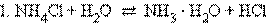
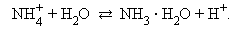

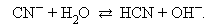

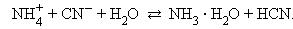
В первом случае гидролиз идет по катиону и pH < 7, во втором по аниону – pH > 7, а в третьем – по аниону и катиону, и величина pH в этом случае зависит от относительной силы образующихся кислоты и основания. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются.
Константа гидролиза для первого случая равна:



Аналогично для гидролиза по аниону

Для гидролиза по катиону и аниону одновременно

Связь константы гидролиза со степенью гидролиза выводится подобно закону разбавления Оствальда и записывается так:
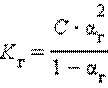
где C – концентрация соли в моль/л.
Для малых значений αг
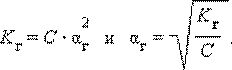
Для многозарядных катионов и анионов гидролиз протекает ступенчато, причем в основном по 1-й ступени.
Например, для хлорида железа (FeCl3 → Fe3+ + 3Cl–) имеем:
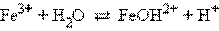


Распространенной ошибкой при составлении уравнений гидролиза является использование сразу более одной молекулы воды.
Сравните:
Правильно:

Неправильно (!):

УСТОЙЧИВОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ В РАСТВОРАХ
В растворе ион металла M и монодентатный лиганд L взаимодействуют ступенчато с образованием комплексного иона [MLn] по схеме:


где Ki – ступенчатые константы образования (устойчивости) отдельных комплексов [MLi].
Поскольку в этой системе существует лишь n независимых равновесий, полная константа процесса M + nL = MLn – общая константа образования:


Чем больше константа устойчивости, тем более прочным является данный комплекс, поскольку ΔG° = –RT lnβ.
Образование прочных комплексных ионов может быть использовано для растворения труднорастворимых электролитов. Концентрация ионов в растворе определяется величиной произведения растворимости такого электролита. Добавляя в раствор вещества, образующие с одним из его ионов комплексное соединение, можно во многих случаях достичь растворения осадка за счет комплексообразования. Добиться этого тем легче, чем больше величина произведения растворимости и чем больше константа устойчивости комплексного иона. Например, хлорид серебра AgCl растворяется в избытке аммиака, образуя [Ag(NH3)2]Cl. Менее растворимый AgI в аммиаке практически не растворим, но растворяется в тиосульфате натрия Na2S2O3 по реакции

поскольку β[Ag(S2O3)2]3– на несколько порядков больше β[Ag(NH3)2]+.
Комплексные ионы участвуют в реакциях обмена с образованием более прочного или менее растворимого соединения:

Здесь M = Ni2+, Cu2+, Fe2+.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 816; Нарушение авторских прав?; Мы поможем в написании вашей работы!