КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовомеханическое описание состояния электрона в атоме. Принцип Паули. Структура электронных оболочек атома
|
|
|
|
Вынужденное излучение. Лазеры.
Периодическая система элементов Менделеева.
Квантовомеханическое описание состояния электрона в атоме. Принцип Паули. Структура электронных оболочек атома.
Вопросы
Элементы современной физики атомов и молекул
Лекция 13
|
В кулоновском поле потенциальная энергия взаимодействия электрона с ядром
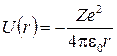 . (1)
. (1)
Состояние электрона описывается волновой функцией, удовлетворяющей уравнению Шрёдингера
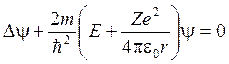 . (2)
. (2)
Это уравнение имеет решения при собственных значениях энергии
 , (
, ( ), (3)
), (3)
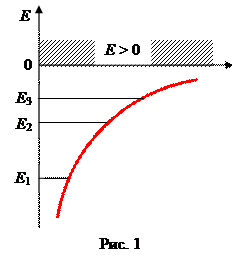
Е 1 - основная энергия; Е 2, Е 3, … - возбужденные энергии; при n ®¥ E ¥ = 0; при E >0 движения электрона свободные, что соответствует ионизированному газу.
Собственная функция y определяется четырьмя квантовыми числами.
1. Главное квантовое число n определяет энергетические уровни электрона в атоме и принимает любые целочисленные значения, начиная с 1:
n = 1, 2, 3, ….
| Номер орбиты n | ||||
| Обозначение орбиты | K | L | M | N |
2. Орбитальное квантовое число l определяет уровни момента импульса, которые при заданном n принимают значения
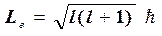 , l = 0, 1, …, n- 1 (4)
, l = 0, 1, …, n- 1 (4)
| Номер l | ||||
| Обозначение состояния электрона | s | p | d | f |
Орбитальное квантовое число введено после опытов немецкого теоретика Арнольда Зоммерфельда, который при исследовании спектров испускания щелочных металлов обнаружены линии, которые не позволяла рассчитать теория Бора.
3. Магнитное квантовое число ml определяет проекцию момента импульса электрона на заданное направление
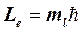
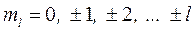 . (5)
. (5)
4. Магнитное спиновое квантовое число ms характеризует направление собственного вращения электрона.

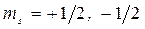 . (6)
. (6)
Магнитное спиновое квантовое число введено после опытов Штерна и Герлаха в 1922 г. Они обнаружили расщепление пучка энергии атома водорода в s -состоянии в неоднородном магнитном поле на два пучка. С пин - собственный момент импульса электрона.
|
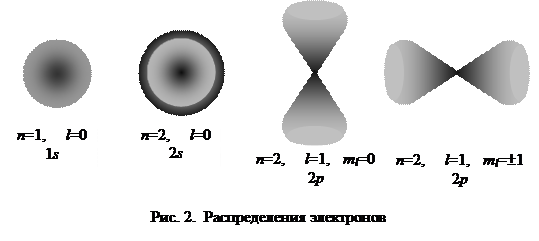
Квантовые числа n, и Le характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве.
Итак, состояние электрона определяют четыре квантовых числа:
· главное n, n = 1 (K), 2(L), 3(M), 4(N),…;
· орбитальное l, l = 0(s), 1(p), 2(d), 3(f),…, n -1;
· магнитное ml, ml = - l, …, -1, 0, +1, …, + l;
· магнитное спиновое ms, ms = +1/2, -1/2.
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой оболочке имеются подоболочки соответственно l.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 458; Нарушение авторских прав?; Мы поможем в написании вашей работы!