
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механические свойства живых тканей
|
|
|
|
Лекция № 17
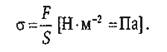 |
Биомеханика − раздел биофизики, посвященный изучению механических свойств живых тканей и органов, а также механических процессов, происходящих в них при жизнедеятельности. Они проявляются в их реакциях на механические воздействия. Мерой взаимодействия физических тел служит сила. Сила, действующая на единицу площади поверхности тела, называется поверхностной силой, или поверхностной нагрузкой (σ):
(57)
Именно этой физической величиной принято характеризовать в биомеханике механические воздействия на живые ткани и органы. Символом σ обозначают механические усилия, развивающиеся в тканях и органах при различных воздействиях на них. Эти усилия называют напряжением и обозначают символом σ int, а внешнее механическое воздействие характеризуют параметром σ ext. Далее для обозначения внешнего механического воздействия на живые ткани будет использоваться символ σ (без индекса «ext»), а для характеристики усилий, развивающихся в них, − символ σint. При механическом воздействии живые ткани деформируются, т. е. изменяют свои размеры и форму. Различают упругую и остаточную деформации.
Упругая деформация исчезает, а остаточная − сохраняется после снятия вызвавших их поверхностных сил. Все молекулы, образующие упругие тела, возвращаются в свои исходные положения после снятия нагрузки. Различия между упругой и остаточной деформациями четко проявляются в основной характеристике механических свойств физической среды − функциональной зависимости относи
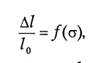 |
тельной деформации (
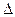 l/l0) от приложенной поверхностной силы:
l/l0) от приложенной поверхностной силы:
(58)
где l 0 − исходный линейный размер тела; 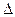 l − его изменение при механическом воздействии.
l − его изменение при механическом воздействии.
Упругая деформация подчиняется закону Гука:
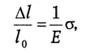 (59)
(59)
где Е − модуль нормальной упругости (модуль Юнга).
Понятно, что 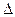 l/l0 = 1, если при растяжении длина исследуемого образца увеличивается в 2 раза. Следовательно, модуль Юнга численно равен напряжению под действием которого исследуемый образец удлиняется вдвое. Его единица измерения: [Н · м-2 = Па].
l/l0 = 1, если при растяжении длина исследуемого образца увеличивается в 2 раза. Следовательно, модуль Юнга численно равен напряжению под действием которого исследуемый образец удлиняется вдвое. Его единица измерения: [Н · м-2 = Па].
Кроме относительного удлинения, под действием механических усилий может возникать деформация сдвига, которую оценивают модулем упругости при сдвиге (G), равным отношению напряжения сдвига к величине относительного сдвига. Его единицей измерения также служит паскаль (Па). Относительный сдвиг измеряется углом 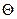 (в радианах). При малой деформации
(в радианах). При малой деформации 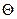 =AB/ l (рис. 63).
=AB/ l (рис. 63).

Рис. 63. Определение относительного сдвига
При действии механической силы, которая растягивает образец не строго перпендикулярно или параллельно его торцевой плоскости, поверхностную нагрузку можно разложить на нормальную (σ n) и тангенциальную (σ 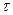 ) составляющие. В таком случае тело испытывает два вида деформации: 1) относительное удлинение (
) составляющие. В таком случае тело испытывает два вида деформации: 1) относительное удлинение (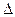 l/l0) и 2) относительный сдвиг (
l/l0) и 2) относительный сдвиг (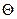 ).
).
В реальных условиях удлинение исследуемого образца обычно сопровождается уменьшением его поперечного сечения. Взятое по модулю отношение поперечного относительного сжатия тела к продольному относительному удлинению в пределах соблюдения закона Гука называют коэффициентом Пуассона. Это безразмерная величина. Если живые ткани мало деформируются, то в них целесообразно определять не модуль упругости, а коэффициент жесткости. Жесткость характеризует способность физической среды сопротивляться образованию деформаций.
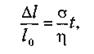 |
Остаточная деформация присуща физическим средам, обладающим вязкостью. При приложении механической силы к вязкому телу в нем вначале возникает сила упругости, но с течением времени она уменьшается по экспоненциальному закону. Время, в течение которого сила упругости ослабевает в е раз, называется временем релаксации.
(60)
Вязкость при одноосном растяжении исследуемого образца называется продольной, при деформации сдвига − сдвиговой, при деформации внешнего сжатия − объемной. Вязкостью обладают не только жидкости и газы, но и твердые тела. Она характеризует свойство физических сред оказывать сопротивление перемещению одной части среды относительно соседних частей. Например, при движении жидкости или газа по трубе их различные слои перемещаются (текут) с неодинаковой скоростью. Профиль скорости в разных участках сечения трубы имеет форму параболы (рис. 63), причем скорость максимальна на оси трубы (как можно дальше от стенки) и равна нулю у стенки (пристеночный слой жидкости неподвижен). Следовательно, между слоями перемещающейся среды существует градиент скорости.
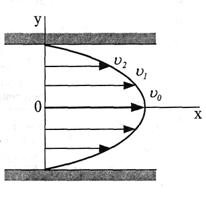
Рис. 63. Примерное распределение скорости частиц жидкости в продольном сечении кровеносного сосуда
Его принято называть скоростью сдвига:
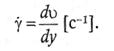 (61)
(61)
С градиентом скорости в поперечном профиле трубы связана сила внутреннего трения (Fmp) движущихся жидкости или газа.
Функциональная зависимость между ними выражается формулой Ньютона:
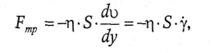 (62)
(62)
где S − площадь поверхности взаимодействующих слоев, между которыми существует данный градиент скорости: (dv/dy)
Из формулы Ньютона следуют выражение для определения коэффициента вязкости (для жидкости − коэффициента сдвиговой или динамической вязкости) и его единица измерения:
 (63)
(63)
В системе СИ единица измерения коэффициента динамической вязкости − паскалъ-секунда, а в системе СГС вязкость выражают в пуазах (П). В биологии медицине вязкость обычно измеряют в сантипуазах (сП). Соотношение между единицами вязкости: 1 Па · с = 10 П = 103 сП. Следовательно, 1 сП = 1 мПа · с. Физическая величина, обратная динамической вязкости, называется текучестью. Кроме динамической вязкости, которая количественно характеризует сопротивление смещению одного слоя физической среды относительно соседних слоев, в биомеханике фигурирует и такая величина, как кинематическая вязкость (v), которая равна отношению динамической вязкости к плотности физической среды (ρ):
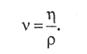 |
(64)
Вязкостью обладают не только жидкости и газы но и твердые тела. В них также возникает градиент скорости между движущимися слоями и, следовательно, существует внутреннее трение. Будучи сложными композиционными средами, в которых компоненты обладают разными механическими свойствами, живые ткани относятся к вязко-упругим и упруго-вязким механическим системам (в зависимости от преобладания упругих или вязкостных свойств).
Если растягивать живую ткань и исследовать функциональную зависимость ее напряжения (σint) от растяжения, а затем предоставить ей возможность возвращаться в исходное состояние и измерять σ int при разной степени укорочения, то построенные кривые не совпадают (рис. 64).
|


Этот график называется петлей гистерезиса. Площадь внутри петли гистерезиса соответствует энергии, потерянной в процессе растяжения и последующего упругого укорочения. Она рассеивается в виде тепла. Отношение работы, совершаемой исследуемым материалом (включая живые ткани) при упругом восстановлении первоначальной формы, к работе, затраченной ранее на его деформацию, называется резильянсом. Его выражают в процентах. Гистерезис в мягких тканях определяется пластическими деформациями, создаваемыми остаточными внутренними напряжениями.
Преимущественное проявление упругих или вязкостных свойств в живых тканях зависит от характера воздействия на них механической силы. При ее длительном приложении (дольше времени релаксации) преобладают вязкостные свойства. Кратковременное приложение силы выявляет в основном упругие свойства живой ткани, поскольку реакции ее вязких компонентов не успевают развиться. Даже для кости закон Гука справедлив только при ее быстрой деформации. Гладкие мышцы и другие компоненты стенок полых органов (желчного и мочевого пузырей, желудка, кишечника, венозных и лимфатических сосудов и т. д.) испытывают обычно длительное воздействие постепенно нарастающих растягивающих усилий. Только в самом начале действия силы они напрягаются, проявляя свои слабые упругие свойства, но затем напряжение их постепенно ослабевает благодаря деформации компонентов, обладающих вязкостными свойствами. Поэтому полые органы способны сильно растягиваться без развития напряжения, вследствие присущей им выраженной остаточной деформации. Такое механическое свойство живых тканей называется пластичностью. В системе кровообращения оно присуще венам. Благодаря пластичности мелкие венозные сосуды вмещают более двух третей всей крови человека. Их принято называть сосудами емкостного типа.
В биомеханике все ткани человека подразделяют по плотности и типу пространственной структуры на твердые (кость, эмаль и дентин зубов), мягкие (мышцы, эпителий, эндотелий, соединительная ткань, паренхима), жидкие (кровь, лимфа, ликвор, слюна, сперма).
Для многих живых тканей характерна нелинейная зависимость относительной деформации от приложенной поверхностной силы. Это означает, что их модуль Юнга не константа, а переменная величина, изменяющаяся в зависимости от σ и степени деформации. Модуль Юнга увеличивается по мере нарастания напряжения в силу разной природы упругих свойств биополимеров при малых и больших деформациях. Молекулы, входящие в состав биополимеров, образуют многочисленные звенья, расположенные под углом друг к другу. Расположение звеньев определяется вторым началом термодинамики, соответствуя максимуму термодинамической вероятности. Под действием небольших усилий удлинение происходит за счет поворота звеньев, т. е. изменения ориентации и формы молекул. Если же напряжение превзойдет определенный предел, то звенья начинают не только поворачиваться, но и растягиваться за счет увеличения межатомных расстояний в молекулах. Чтобы растянуть звенья биополимеров, требуется гораздо большая сила, чем для их поворота. Проявлением перехода от первого ко второму типу процессов, обеспечивающих упругие свойства биополимера, служит резкое (скачком) возрастание модуля Юнга, начиная с определенного значения σ. В этом одна из причин нелинейной зависимости относительной деформации живых тканей от приложенного к ним напряжения.
Большая или меньшая выраженность нелинейности является наглядным критерием различий в механических свойствах разных тканей. Нелинейность ярко выражена в стенках артерий. Их деформация начинает развиваться уже при слабых усилиях (при повышении кровяного давления), но как только степень деформации достигнет физиологического предела прочности, потребуются гораздо большие усилия для дальнейшего растяжения сосудистой стенки. Тем самым предотвращается ее повреждение (разрыв). Подобным образом ведут себя все живые ткани, в которых зависимость Δ l от σ имеет нелинейный характер. Такая нелинейность присуща скелетным мышцам, особенно в состоянии сокращения. При малых деформациях модуль Юнга мышечной ткани сравнительно невелик (около 104 Па), а по мере увеличения деформации возрастает в десятки раз.
В живых тканях, как и в других композиционных средах, обладающих вязко-упругими и упруго-вязкими свойствами, процессы деформации развиваются в определенной последовательности. Сразу после приложения нагрузки возникает мгновенная упругая деформация. С некоторым запаздыванием начинается медленная упругая деформация, которая на всем протяжении действия нагрузки постепенно нарастает с убывающей скоростью. На этот процесс накладывается вязкое течение компонентов живой ткани, возрастающее с постоянной скоростью пока на нее действует механическое усилие и сохраняющееся после снятия нагрузки.
Соотношение продолжительности этих процессов зависит от времени действия на ткань механического усилия: чем оно короче, тем в большей степени живая ткань напоминает упругое тело, и в ее реакции доминирует первый процесс, тогда как при длительном механическом воздействии живая ткань (даже такая, как кость) проявляет свойства вязкого тела, в частности пластичность (способность к остаточной деформации) и ползучесть (непрерывную пластическую деформацию под действием постоянной нагрузки).
Одним из важнейших механических свойств живых тканей является их прочность − способность противостоять разрушению, выдерживая заданную нагрузку. Она определяется как величина, прямо пропорциональная минимальной разрушающей поверхностной силе (σ Р min). Наибольшей прочностью отличается костная ткань, которая начинает разрушаться при  Р min порядка 108 Па. При внезапном ударе прочность живых тканей меньше, чем в условиях медленного развития деформации.
Р min порядка 108 Па. При внезапном ударе прочность живых тканей меньше, чем в условиях медленного развития деформации.
Прочность мягких тканей определяется прежде всего присутствием в них соединительнотканных волокон, среди которых наиболее прочны коллагеновые. Их прочность на растяжение немного меньше, чем у костной ткани ( Р min = 107−108 Па), но они составляют лишь небольшую часть органа, образованного мягки ми тканями. Поэтому любой из органов обладает гораздо меньшей прочностью, чем кости, в прочность которых к тому же вносят вклад не только коллагеновые волокна, но и минеральные компоненты (главным образом, кристаллы гидроксиапатита). Стенки крупных артерий разрываются при
Р min = 107−108 Па), но они составляют лишь небольшую часть органа, образованного мягки ми тканями. Поэтому любой из органов обладает гораздо меньшей прочностью, чем кости, в прочность которых к тому же вносят вклад не только коллагеновые волокна, но и минеральные компоненты (главным образом, кристаллы гидроксиапатита). Стенки крупных артерий разрываются при  Р min = 3 · 106 Па, а стенки вен − при
Р min = 3 · 106 Па, а стенки вен − при  pmin=5 · 105 Па.
pmin=5 · 105 Па.
Стенки артерии и желудочков сердца в большей степени, чем другие ткани организма, подвержены продолжительной переменной нагрузке (механическим колебаниям). В таких условиях многие материалы разрушаются при нагрузках, меньших предела прочности. Это явление называется усталостью материала. Живые ткани обладают поразительно высокой способностью противостоять механической усталости. Она не накапливается в живых тканях благодаря их непрерывному обновлению, связанному с высоким уровнем метаболизма и продукции энтропии, эффективно компенсируемой потоком отрицательной энтропии. С возрастом интенсивность обмена веществ и энергии понижается, обновление тканей замедляется, в результате чего изменяется их прочность. В большинстве органов и тканей прочность начинает уменьшаться в 20-летнем, а в коже и зубах − в 50-летнем возрасте.
Механические свойства тканей животных и человека обусловлены в значительной степени следующими биополимерами: коллагеном, эластином, гликоза-миногликанами, гликопротеинами и растворимыми протеинами. Во внеклеточной среде коллаген и эластин образуют волокна, а остальные биополимеры − основное вещество соединительной ткани.
Коллаген синтезируется разными клетками соединительной ткани (фиброблас-тами, хондробластами, остеобластами), эпителиоцитами и эндотелиоцитами, а потому представлен довольно большой (до 14 типов) группой очень стабильных трехспиральных белковых молекул. У высших позвоночных на его долю приходится около трети всех белков организма. У человека 50% всего коллагена содержится в костях, где он составляет 90% органического матрикса. Вторая половина сосредоточена в соединительной ткани, хряще, стенках сосудов, базальных мембранах многомембранных систем и т. д. Молекула коллагена состоит из трех полипептидных цепей, в каждой из которых примерно 1000 аминокислотных остатков, среди которых доминирует глицил − на его долю приходится примерно 33% всех аминокислотных остатков первичной структуры коллагена. Кроме глицила, в коллагене много аланила, пролила, оксипролила и оксилизила. Два последних специфичны для коллагена. Вторичная структура − 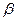 -спираль с левосторонним направлением вращения. Три таких
-спираль с левосторонним направлением вращения. Три таких  -спирали посредством поперечных связей свиваются в тройную спираль (спирализованную суперструктуру) − тропоколлаген диаметром 1,0−1,5 нм и длиной до 270 нм. Цепи коллагена I типа имеют несколько потенциальных мест для образования поперечных связей, а также по одному участку для присоединения N- и С-терминальных фрагментов.
-спирали посредством поперечных связей свиваются в тройную спираль (спирализованную суперструктуру) − тропоколлаген диаметром 1,0−1,5 нм и длиной до 270 нм. Цепи коллагена I типа имеют несколько потенциальных мест для образования поперечных связей, а также по одному участку для присоединения N- и С-терминальных фрагментов.
Тройные спирали тропоколлагена полимеризуются, объединяясь ковалентны-ми связями также в спиралевидные фибриллы диаметром 1−12 мкм и длиной до 10 мкм, а те, в свою очередь, объединяются в коллагеновые волокна разной толщины (от 20 до 200 мкм). Четвертичные коллагеновые структуры тоже стабилизируются поперечными связями. Такое завершение строительства коллагеновых волокон осуществляется во внеклеточной среде. В костях они называются оссеиновыми, а в хрящах − хондриновыми волокнами. В кислой среде волокна разрушаются протеазами на молекулярные фрагменты. Такое разрушение оссеиновых волокон происходит, например, при резорбции кости остеокластами в процессе ее ремоделирования.
В сухожилиях, связках, стенках кровеносных сосудов коллагеновые волокна не переплетаются и в покое имеют гофрированные очертания, будучи уложены «со слабиной», а не «внатяг». При растягивании они вначале распрямляются, а затем могут удлиняться (без разрыва) не более чем на 10−20%. При таком удлинении предел прочности составляет (0,5−1,0) · 109 Па, а модуль Юнга − 107−108 Па, тогда как при распрямлении он на 3−4 порядка меньше. В коже (дерме) коллагеновые волокна организованы в трехмерную сетку фибрилл, образующих волнистые ромбы.
Эластин − фибриллярный гликопротеин с молекулярной массой 70 кДа, обладающий упругостью. Она обусловлена обилием в первичной структуре (полипептидной цепи) аминокислотных остатков с неполярными группами. Среди них много пролила и глицила (как в коллагене), но очень мало гидроксипролила и отсутствует гидроксилизил. Молекулы эластина секретируются клетками во внеклеточное пространство. Там из них образуются волокна и слои, в которых отдельные молекулы связаны ковалентными сшивками в обширную сеть.
У эластина нет определенной третичной структуры − его полипептидная цепь может переходить от одной конформации к другой, от нее − к третьей и так далее. Под действием внешней силы каждая молекула способна растягиваться и сжиматься, вследствие чего вся эластиновая сеть может растягиваться и сжиматься наподобие резины (рис. 65).
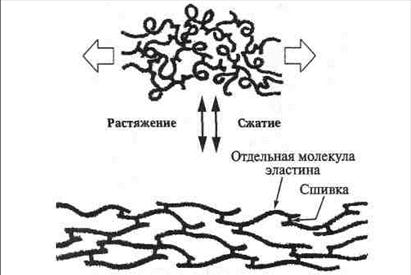
Рис. 65. Деформация молекул эластина при растяжении
Полипептидные цепи, соединенные друг с другом в определенных местах жесткими связями, образуют парные спирально скрученные нити. Они объединяются в волокна, в которых есть участки как с упорядоченным, так и с беспорядочным расположением молекул. Эластические волокна имеют модуль Юнга от 105 до 107 Па и способны растягиваться более чем в 2 раза, т. е. на 200%, а не на 10−20%, как коллагеновые. У человека много эластина содержится в восходящем отделе аорты.
Основное вещество соединительной ткани образовано гликопротеинами и гли-козаминогликанами (их раньше называли мукополисахаридами). Оно имеет очень невысокий модуль Юнга, относится к вязким средам и выполняет три биомеханические функции:
1) перераспределение нагрузки между волокнами;
2) эффективную изоляцию отдельных волокон, что предотвращает распространение разрывов при их локальном возникновении;
3) уменьшение трения при распрямлении коллагеновых волокон.
Ультраструктурной основой механических свойств живых клеток является цитоскелет. Он включает нити трех типов: промежуточные филаменты, которые в разных тканях имеют различную молекулярную природу; микрофиламенты, образованные актином; микротрубочки, построенные из тубулина.
В эпителиоцитах промежуточные филаменты формируются из кератинов, в миоцитах − из десмина, в клетках соединительной ткани и других производных мезенхимы − из виментина, в нейронах − из белков нейрофиламентов. Диаметр промежуточных филаментов составляет 8−10 нм, т. е. больше диаметра микрофи-ламента и меньше диаметра микротрубочки. Основное предназначение промежуточных филаментов − обеспечение прочности, поскольку они самые прочные компоненты цитоскелета.
Кератином, а также коллагеном и эластином обусловлены уникальные механические свойства кожи как прочного покрытия тела. Ее толщина в разных частях тела колеблется от 0,5 до 4 мм. Коллаген составляет 75%, а эластин − 4% сухой массы кожи. Общая поверхность кожного покрова человека среднего роста примерно 1,5—1,6 м2. Коже принадлежит важная роль в защите внутренних органов и костей от механических повреждений. Энергия, необходимая для разрушения кости, защищенной кожей, в среднем на 37% больше, чем при ударе по обнаженной кости. Большая доля упруго-вязких пучков в коже ориентирована в поперечном направлении относительно продольной оси тела. Поэтому растяжение кожи в продольном направлении примерно вдвое больше, чем в поперечном. Наилучшей способностью к растяжению обладает кожа 9-летнего ребенка, уже к 17 годам ее растяжимость (в первую очередь, на шее) уменьшается и далее неуклонно падает, становясь к 50 годам примерно вдвое хуже, чем в 9 лет.
Наименьшей прочностью кожа обладает по отношению к ударным нагрузкам и зависит от площади индектора (предмета, которым наносится механический удар) − так, пороговая энергия повреждения кожи при воздействии затупленного индектора достигает 1 Дж, а заостренный индектор повреждает кожу при энергии удара в 0,1 Дж.
Компоненты цитоскелета беспрестанно то укорачиваются, то удлиняются посредством чередования полимеризации и деполимеризации. Иными словами, структурные элементы цитоскелета могут с большой скоростью распадаться на сравнительно мелкие молекулы и вновь собираться в крупные молекулярные комплексы определенной формы. Таким образом, обеспечивается сочетание стабильности с динамичностью цитоскелета.
Система микрофиламентов (тонких нитей). Микрофиламенты построены молекулами глобулярного белка актина (G-актина), впервые выделенного Б. Штраубом в 1948 г. Этот консервативный белок, в структуре которого ничего не изменилось от амебы до человека, экспрессируется в клетках всех органов и тканей. Его полипептидная цепь (первичная структура) включает 374 аминокислотных остатка. Молекулярная масса − 41,8 кДа. Третичная структура представляет собой глобулу с бугристой поверхностью, изрезанной щелями, самая глубокая из которых пролегает в середине молекулы и содержит активные центры связывания АТФ и АДФ, а также Са2+ и Mg2+. Кроме того, на молекуле G-актина есть сайты связывания тропомиозина, тропонина, головки миозина, а также соседних молекул G-актина.
Благодаря активным центрам связывания на G-актине глобулы объединяются в фибриллы, образуя F-актин. Контакты между соседними мономерами G-актина
обеспечиваются гидрофобными и электростатическими взаимодействиями. Фибриллы F-актина объединяются попарно (наподобие пары перекрученных ниток бус), и таким образом формируется актиновый микрофиламент длиной до 1 мкм и диаметром (толщиной) около 6−8 нм. Шаг спирали (полный виток) F-актина составляет 77 нм и на его протяжении содержится примерно 14 пар молекул G-актина. Актиновый микрофиламент − весьма динамичная полярная структура, причем на ее положительном полюсе происходит полимеризация (присоединение новых G-мономеров к F-актину), а на противоположном (отрицательном полюсе) поляризованной молекулы − деполимеризация. Поэтому актиновая нить непрерывно растет в сторону своего положительного полюса и столь же непрерывно укорачивается на отрицательном полюсе (противоположном конце). Полимеризация актина регулируется несколькими белками и обеспечивается энергией посредством гидролиза АТФ, причем образующийся в этой реакции АДФ остается на F-актине. Он замещается молекулами АТФ на отрицательном полюсе актиновой нити при ее укорочении.
Актиновые микрофиламенты прикрепляются внутри клетки к плоским дискообразным ультраструктурам, которые, в свою очередь, «заякориваются» на внутренней поверхности плазмолеммы или на мембранах органоидов. Функцию якоря выполняют такие белки, как винкулин (vincula − связь), спектрин, анкирин (от лат. апкуrа − крюк), десмин (desmos − связь).
Отдельные актиновые нити группируются в пучки, которые либо тянутся через всю цитоплазму, либо образуют осевые стержни, поддерживающие поверхностные выросты клетки (например, микроворсинки), либо переплетаются в виде паутины, укрепляя плазмолемму. Почти во всех клетках (за исключением миоцитов) большая часть нитей вовлечена в формирование актинового кортекса (cortex − кора), который залегает под плазмолеммой наподобие паутинообразной сетки. Благодаря тому, что в кортексе микрофиламенты сплетаются в сложные сети, он при сжатии клетки деформируется во всех направлениях. Средняя продолжительность жизни актиновой нити коротка − например, в кортексе лейкоцита всего 5 секунд.
Актиновый кортекс испытывает существенные перестройки при образовании клеткой псевдоподий (ложных ножек) − выростов цитоплазмы в сторону интер-стиция. На их возникновение уходит несколько минут, а то и секунд. Внутри каждой псевдоподии находятся кортикальные микрофиламенты, которые на протяжении ее жизни беспрестанно полимеризуются и деполимеризуются. Кончик псевдоподии способен временно прикрепляться к поверхностям, по которым ползет клетка (например, лейкоцит). В псевдоподии для перемещения клетки должен находиться не только актин, но и миозин, взаимодействующий с актиновыми нитями, выполняющими функцию рельсов, по которым движется (скользит) миозин, относящийся к так называемым белкам-моторам («цитомышцам»). Выделено несколько типов миозинов. Внутриклеточный транспорт осуществляется преимущественно миозином I типа.
Молекула миозина II типа, который обеспечивает сокращение миоцитов, образована четырьмя полипептидными цепями, две из которых (тяжелые) имеют молекулярную массу по 200 кДа, а две легкие − 20 и 17 кДа. Следовательно, молекулярная масса этого гиганта достигает почти 500 кДа. Каждая из двух тяжелых цепей образует вторичную структуру типа α -спирали. Спирали обеих цепей скручены в двухнитчатую (левозакрученную) суперспираль с шагом в 7,5 нм (рис. 66, а).
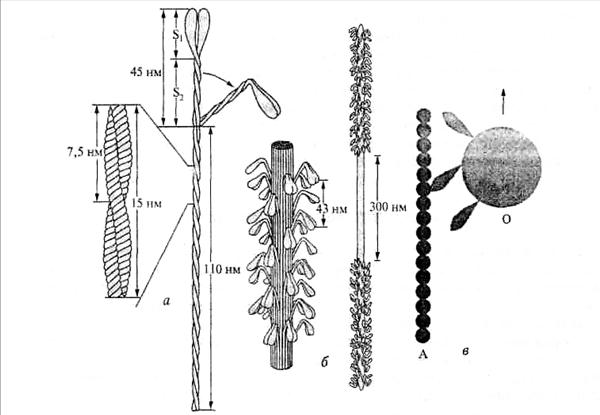
Рис. 66. Миозиновые нити: а – двухнитчатая структура миозина II(белковая молекула с двумя головками); б – (стержни) толщиной 15 – 20 нм с многочисленными головками, выступающими над поверхностью и образующими регулярные спиральные ряды, в середине стержня – оголенный сегмент без головок; в - молекулы миозина I типа (М), которые прикреплены короткими хвостами к мембране транспортируемого органоида (О), а головками – к актиновой нити (А)
Она является стержнем миозиновой молекулы, который по своей длине (135 нм) при толщине в 2 нм превосходит все аналогичные молекулярные структуры, встречающиеся в природе.
На верхнем конце стержня две нити расходятся, чтобы образовать подвижные «стебельки», на вершинах которых тяжелые полипептидные цепи сплетаются с дополнительными (легкими) цепями и формируют глобулярные молекулярные структуры, которые, как поникшие головки, выступают на поверхности. За счет них общая длина миозиновой молекулы достигает 155 нм. Молекула напоминает двойной цветок на длинной ножке. Соединение между головкой и стержнем молекулы подобно шарниру, что позволяет «цветам» наклоняться в той или иной степени. Головки миозина обладают АТФазной активностью, т. е. активируют гидролиз АТФ.
Миозиновые молекулы самопроизвольно собираются в пучок. При таком объединении стержни нескольких сотен молекул, располагаясь параллельно друг другу с некоторым сдвигом по длине (относительно расположения головок), образуют своеобразный ствол толщиной 11−14 нм, из которого в верхней его части выступают головки (рис. 66, б). Эта надмолекулярная структура биполярна, поскольку в ее середине соединяются (конец в конец) два «ствола» при том, что «кроны» обращены в противоположные стороны. Поэтому в середине толстой нити, в которой объединены сотни молекул миозина, имеется участок длиной около 300 нм, свободный от головок. Общая длина всего такого филамента составляет в разных клетках от 2,5 до 15 мкм.
В миозине I типа, который обеспечивает внутриклеточный транспорт органоидов (митохондрий, лизосом и др.), «хвосты» короткие. Ими миозиновые молекулы присоединяются к мембранам органоидов и, скользя затем по актиновым нитям, перемещают их в различные участки клетки (рис. 66, в). В таком варианте могут работать даже отдельные молекулы миозина или тонкие пучки, образованные их малым количеством. Благодаря способности к беспрестанным процессам сборки и разборки, протекающим очень быстро, нити F-актина могут достигать любого участка клетки, а по ним, как по рельсам, туда устремляется миозин, который подобно локомотиву тянет за собой различные клеточные компоненты, прикрепляющиеся к нему.
За счет скольжения миозина I типа по микрофибриллам движутся органоиды в цитоплазме (например, митохондрии подтягиваются к тем местам, где есть нужда в макроэргах), а при скольжении миозина II типа перемещаются отдельные участки клетки друг относительно друга. Взаимодействие миозина с актином обеспечивает животным и человеку преодоление земного притяжения и перемещение в пространстве, кровообращение, внешнее дыхание, двигательную активность желудочно-кишечного тракта и других внутренних органов, родовую деятельность и другие виды подвижности, которые обеспечиваются миоцитами разных типов.
Система микротрубочек. Третьим компонентом цитоскелета служат микротрубочки (микротубулы). Они представляют собой полые цилиндры, стенка которых образована молекулами глобулярного белка − тубулина. Его не очень крупные (диаметром около 4 нм и молекулярной массой примерно 115 кДа) молекулы обладают полярностью и полимеризуются на стороне положительного полюса (подобно G-актину). Поэтому сборка микротрубочек посредством полимеризации тубулина происходит путем «наступления» положительных полюсов тубулиновых глобул от центров к периферии. Наличие комплементарной оси типа «замок-ключ» позволяет осуществлять безграничное линейное объединение молекул тубулина.
Различают 2 модификации тубулина (α и β), причем соединения этих близкородственных белков между собой более прочные, чем между тубулинами одноименной модификации. Поэтому распад микротрубочек при их перестройках происходит не до элементарных молекул тубулина (α или β), а до димеров − α - β –соединений, вследствие чего аналогом (эквивалентом) G-актина, из которого строится F-актин, считают не мономеры тубулина, а его α - β - гетеродимер. Из таких димеров тубулина посредством их линейного объединения за счет образования β - α - связей в клетках собираются тубулиновые протофиламенты, т. е. первичные нитеобразные ультраструктуры. В них субъединицы в силу присущих им асимметрии и полярности расположены вдоль оси полимера по принципу «голова к хвосту». Поэтому каждый протофиламент напоминает длинную стрелу, состоящую из коротких стрелок, направленных в одну и ту же сторону.
Каждая молекула α и β -тубулина имеет и вторую систему «ключ-замок», т. е. обладает способностью образовать боковые связи с тубулинами соседних прото-филаментов. Эта латеральная сборка происходит ступенчато, в результате чего каждая α и β - субъединица одного протофиламента взаимодействует с α и β -субъединицами соседних протофиламентов, сдвинутых примерно на четверть ее длины.
Формирующийся таким образом полимолекулярный пласт из 13 протофиламентов приобретает изогнутую поверхность и выстраивается в полый цилиндр, наружный диаметр которого составляет 28 нм, а внутренний (ограничивающий полость) − 14 нм.
Ступенчатый характер бокового соединения протофиламентов приводит не только к возникновению цилиндрической структуры, но и к спиральной периодичности идентичных субъединиц.
Подобно микрофиламентам, микротубулы беспрестанно распадаются и созидаются. Ими образованы многие внутриклеточные ультраструктуры. Во всех клетках они играют роль внутриклеточного каркаса с прекрасными механическими свойствами. Микротрубочками укреплены отростки нейронов. В аксонах по каналам в микротубулах перемещаются от тела нейрона на периферию разнообразные вещества со скоростью до 8 мкм · с-1 (это называется аксональным током).
Вместе с тем микротубулы, как и микрофиламенты, служат «рельсами», по которым не внутри, как аксональный ток, а по наружной поверхности перемещаются (скользят) белки-моторы (динеины и кинезины). Они одним своим концом контактируют с наружной поверхностью микротрубочки и при гидролизе АТФ могут двигаться по ней. Другой конец молекулы-мотора может прикрепляться к органоидам или к соседним трубочкам. В первом случае обеспечивается транспорт органоидов по цитоплазме, а во втором − перемещение отдельных участков клетки относительно соседних.
Следует отметить, что компоненты цитоскелета, в отличие от внеклеточных структур (главным образом, коллагеновых и эластических волокон), обеспечивают не только пассивные механические свойства живых тканей, но также активные механические процессы.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3022; Нарушение авторских прав?; Мы поможем в написании вашей работы!