КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение. Сопоставление строения и свойств
|
|
|
|
Сопоставление строения и свойств
HCl
3+ _
Более характерны восстановительные свойства
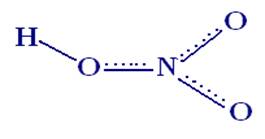
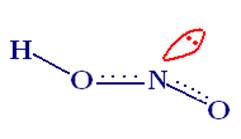
Гипоазотистая (азотноватистая) кислота
HON = NOH.
| |||
2.1 Строение:
2.2. рКa ~ 7
2.4. Получение: а)2 NaNO2 + [H] ® Na2O2 ® (AgON)2¯ ®
® (HON)2 ® N2O + H2O (разлагается)
|
 б) Н2N–OH + HNO2 ® (HON)2 + Н2О
б) Н2N–OH + HNO2 ® (HON)2 + Н2О
HNO2 и HNO3
3.1 Получение Ba(NO2)2 + H2SO4 = 2 HNO2 + BaSO4¯
2 NaNO3, тв + H2SO4, конц = 2HNO3 + Na2SO4
Задача: Получить HNO3 из воздуха.



|


|
|

|
|
|


|
|
|
|
|

 N*+ e N*+ e
| 2s | 2p | O* | ||||||||
| ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ||||||
| sp2 | 2s | 2p | |||||||||
3.3. Свойства HNO2 и HNO3
Таблица 2. Свойства HNO2 и HNO3
| Свойство | HNO2 | HNO3 | |||||
| 1. | 100%-ная | Не существует | а) бесцветная жидкость
Тпл= -42оС; Ткип= 84оС
b) 2HNO3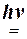 2NO2 +
+ H2O + 1/2 O2 2NO2 +
+ H2O + 1/2 O2
| ||||
| 2. | Автоионизация жидких кислот | Нет | 2HNO3 = NO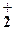 + NO + NO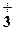 +
+ H2O +
+ H2O
| ||||
| 3. | Влияние нагревания | V
2HNO2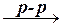 HNO3 +
II
+ 2 NO + H2O HNO3 +
II
+ 2 NO + H2O
| 2HNO3 = 2NO2 + H2O + + 1/2 O2 | ||||
| 4. | pKa = -log Ka | 3.32
H+ + NO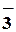 ⇄HO–NO⇄ ⇄HO- + NO+ ⇄HO–NO⇄ ⇄HO- + NO+
|  -1,3 – очень сильная
HNO3 +Н2О = H3O+ +
+ NO -1,3 – очень сильная
HNO3 +Н2О = H3O+ +
+ NO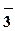
| ||||
| 5. | Действие KMnO4 + + H2SO4 |
 исчезает исчезает
| Нет реакции | ||||
| 6. | KI + H2SO4 | Появляется I2 | Нет реакции | ||||
| 7. | Fe2+ + разб. H2SO4 |
| Нет реакции [Fe(H2O)5NO]2+ | ||||
| 8. | Fe2+ + конц. H2SO4 Реакции корич-невого кольца |   ² ²
|
* 5HNO2 + 2 HMnO4 = 2 Mn(NO3)2 + HNO3 + 3H2O
3+ -1 o 2+
** 2NaNO2 + 2KI + 2H2SO4 = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
*** Fe + NO = NO+ + Fe1+ ® [FeI Н 2O)5NO]2+
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 273; Нарушение авторских прав?; Мы поможем в написании вашей работы!
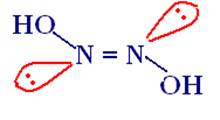 транс-форма
транс-форма