
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подлинность
|
|
|
|
Ароматические кислоты и их соли
Химические свойства обусловлены свойствами —СООН и —ОН групп. При качественном анализе солей ароматических кислот проводят реакции на бензоат- или салицилат-ионы и ион-натрия.
Салицилат-ион и бензоат-ион
1) Реакции комплексообразования с солями тяжелых металлов.
Например, с FeCl3 образуется осадок розовато-желтого основного бензоата железа или сине-фиолетовое окрашивание с салицилат-ионом. См. функциональный анализ.
Комплексы могут быть разного цвета и структуры в зависимости от pH среды и соотношения количества реактива и препарата:
При рН = 2 – 3 – комплекс фиолетового цвета;
рН = 1 – обесцвечивание и белый осадок;
рН = 3 – 8 – красного цвета;
рН = 8 – 10 – желтого цвета (после прибавления раствора аммиака).
С раствором CuSO4 бензоат-ион образует бирюзовое окрашивание, а салицилат - зеленое.



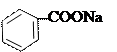 - -
- -
2 + CuSO4 → Cu + Na2SO4
_ _ 2
бензоат натрия бирюзовый цвет
После прибавления хлороформа наблюдается голубой хлороформный слой и бесцветный водный.
 | |||
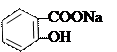 | |||
+ CuSO4 →
салицилат натрия зеленый цвет
После прибавления хлороформа окраска водного слоя сохраняется.
С раствором AgNO3 образуется белый осадок.
Салицилат-ион (отличается наличием –ОН фенольного)
2) Реакция бромирования. При бромировании салицилат-иона идет процесс декарбоксилирования и образуется трибромфенол виде белого осадка. См. функциональный анализ.
3) Декарбоксилирование проводят так же при сплавлении с CH3COONa или цитратом натрия в присутствии H2SO4к. При этом образуется фенол, который определяют по запаху.
4) Реакция образования азокрасителя.
5) Реакция с реактивом Марки.
Реакции на ион-натрия
1) Бесцветное пламя горелки окрашивается в желтый цвет.
2) + Zn уранилацетат → желто-зеленый осадок.
3) При прибавлении HCl сильная минеральная кислота вытесняет из соли слабую кислоту виде белого осадка у которого определяют Тпл.
Ацетилсалициловая кислота.
Химические свойства обусловлены сложно-эфирной группой:
1) Гидролитическое разложение. Реакция основана на разложении в присутствии NaOH или кислоты при нагревании. Ацетилсалициловая кислота гидролизуется легко, даже нагревании в воде.
Щелочной гидролиз:
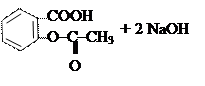 | 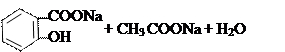 | ||
→
ацетилсалициловая кислота салицилат натрия ацетат натрия
Затем при подкислении выпадает белый осадок салициловой кислоты, можно определить его Тпл. и ощущается запах уксусной кислоты.
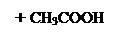
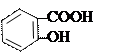
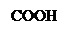 Кислотный гидролиз:
Кислотный гидролиз:

 + Н2О + [H+] → ↓
+ Н2О + [H+] → ↓
ацетилсалициловая кислота салициловая кислота уксусная кислота
2) Гидроксамовая проба. При взаимодействии сложно-эфирной группы и NH2OH∙HCl в щелочной среде образуются гидроксамовые кислоты, которые после подкисления образуют окрашенные гидроксаматы с солями Fe(III) или Cu(II).
Оксафенамид.
Химические свойства обусловлены амидной группой:
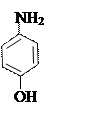
 1) Гидролитическое разложение. При щелочном гидролизе образуются натрия салицилат (его можно открыть реакцией с хлоридом железа) и п -аминофенол, который обнаруживают по реакции образования индофенолового красителя красного цвета.
1) Гидролитическое разложение. При щелочном гидролизе образуются натрия салицилат (его можно открыть реакцией с хлоридом железа) и п -аминофенол, который обнаруживают по реакции образования индофенолового красителя красного цвета.
 | |||
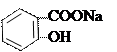 | |||
→ +
оксафенамид натрия салицилат п -аминофенол

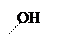 | |||||
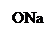 | |||||
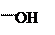 | |||||
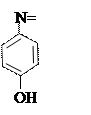



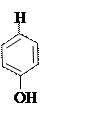
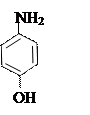
 + + NaOH → + HCl ↔
+ + NaOH → + HCl ↔
п -аминофенол резорцин индофенолят Na синего цвета индофенол красного цвета
2) Гидроксамовая проба.
3) С1-нитрозо-2-нафтолом и НNO3 образуетсявишневое окрашивание.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 7260; Нарушение авторских прав?; Мы поможем в написании вашей работы!