
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модели строения атома
|
|
|
|
Электронное строение атома
Лекция 1
К концу XIX в. были накоплены сведения, подтверждающие сложное строение атома. В тот период был выдвинут целый ряд моделей строения атома. Одна из первых моделей была предложена Дж. Томсоном в 1903 г. В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест Резерфорд на основе данных подготовленного и проведенного им эксперимента сделал вывод, что в атоме положительный заряд сконцентрирован в малом объеме. Ханс Гейгер и Эрнест Марсден были студентами Резерфорда. В 1910 г. они проводили эксперименты, в которых бомбардировали тонкие листы золотой фольги пучком α - частиц (ядер атомов гелия). Это наблюдение заставило Резерфорда выдвинуть новую модель атома, согласно которой положительно заряженное ядро окружено электронами.

|
Рассчитанный на основе данных проведенного эксперимента размер ядра атома оказался примерно в 100 000 раз меньше размера самого атома. После этого в 1920 г. Резерфорд предсказал существование протона и показал, что его масса более чем в 1800 раз должна превышать массу электрона. Экспериментально нейтрон был обнаружен в 1932 г. Началом современной теории электронного строения атомов послужила его планетарная квантовая модель, которую в 1913 г. выдвинул Нильс Бор, согласно которой электроны движутся вокруг ядра по стационарным круговым орбитам (рис. 2).
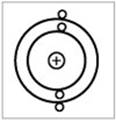
|
Такая модель не согласовывалась с законами классической электродинамики, применимыми к макрообъектам, согласно которым электрон неизбежно терял бы энергию и упал бы на ядро. Это противоречие Бор «устранил» следующим образом: предположив, что микрообъекты существуют по своим, им присущим законам, он выдвинул два постулата.
1. Электроны способны находиться в атоме только на некоторых разрешенных стационарных орбитах; по этим орбитам электроны движутся, не испуская и не поглощая энергии.
2. Излучение или поглощение порции (кванта) энергии происходит при переходе электрона с одной стационарной орбиты на другую.
Бор связал электронные переходы со спектральными линиями атомарного водорода. Атомный спектр испускания водорода представляет собой совокупность линий, среди которых можно различить три группы или серии. Серия линий, находящихся в ультрафиолетовой области, называется серией Лаймана. Серия, находящаяся в видимой области, – серия Бальмера, а в инфракрасной – серия Пашена.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 330; Нарушение авторских прав?; Мы поможем в написании вашей работы!