
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергетические характеристики атомов
|
|
|
|
Энергетические уровни и электронная конфигурация атома
Орбитали
Электронные оболочки в действительности расщеплены на подоболочки. Электронные подоболочки обозначают по типам соответствующих им линий в атомных спектрах: s-подоболочка названа по «резкой» s-линии – sharp; p - по «главной» p-линии – principal; d- по «диффузной» d-линии – diffuse; f- по «фундаментальной» f-линии –fundamental.
Линии, обусловленные переходами между этими подоболочками, испытывают дальнейшее расщепление, если атомы элементов помещены во внешнее магнитное поле. Экспериментально было установлено, что s-линия не расщепляется, р-линия расщепляется на 3, d-линия – на 5, f-линия – на 7.
Все атомы имеют целый ряд возможных энергетических состояний, называемых основным и возбужденными электронными состояниями. При поглощении энергии атом из основного состояния переходит в состояние с большей энергией – возбужденное состояние. В возбужденном состоянии атом находится очень короткое время и через 10–8–10–9с он испускает энергию и «перескакивает» на нижерасположенный энергетический уровень или на уровень основного состояния.
Запись распределения электронов в атоме по электронным уровням и подуровням называется его электронной конфигурацией и может быть сделана как для основного, так и возбужденного состояния атома. Для определения конкретной электронной конфигурации атома в основном состоянии существуют следующие три положения.
· Принцип заполнения (наименьшей энергии). Электроны в основном состоянии заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
· Принцип Паули. На любой орбитали может находиться не более двух электронов, причем с противоположно направленными спинами.
· Правило Гунда. Вырожденные (с одинаковой энергией) орбитали заполняются одиночными электронами с одинаково направленными спинами, лишь после этого идет заполнение вырожденных орбиталей электронами с противоположно направленными спинами согласно принципу Паули. Например, электронная конфигурация атома водорода в основном состоянии записывается в виде: 1S1, где 1 – номер энергетического уровня; S – форма орбитали; 1 – количество электонов.
Особенности электронной структуры различных атомов находят отражение в таких их энергетических характеристиках, как энергия ионизации Е и, сродство к электрону и электроотрицательность. Их значения принято измерять в килоджоулях на моль (кДж/моль).
Энергия ионизации – минимальная энергия, необходимая для удаления электрона из нейтрального атома, находящегося в основном состоянии. Значение E и всегда является положительным. Например, энергия ионизации атома водорода Н(г) = Н+(г) + e, равная +1312,1 кДж/моль, относится к переходу с 1 s -атомной орбитали (АО) на АО с n = 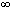 , которой отвечает E
, которой отвечает E 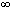 = 0.
= 0.
У многоэлектронных атомов различают первую (Е 1и), вторую (Е 2и), третью (Е 3и) и т.д. энергии ионизации по последовательному удалению электронов из атома. При этом всегда для одного и того же атома Е 1и < Е 2и < Е 3и, поскольку второй, третий и т.д. электроны приходится отрывать от положительно заряженного иона.
Наибольшими значениями энергии ионизации обладают атомы благородных газов, имеющие полностью заселенные электронные оболочки. Наименьшие значения энергии ионизации имеют атомы щелочных металлов с одним валентным электроном, надежно экранированным от сильного воздействия ядра предыдущими заполненными электронными оболочками.
Сродство к электрону – энергия, выделяемая или поглощаемая (отрицательное сродство) при присоединении электрона к нейтральному несвязанному атому, находящемуся в газовой фазе, с образованием отрицательно заряженного иона. Наибольшим сродством к электрону обладают галогены. Например: F(г) + e = F–(г) + 345,7 кДж/моль.
Электроотрицательность – способность атома, связанного с другим атомом, притягивать к себе электронное облако, вызывая тем самым поляризацию связи. Используют различные количественные оценки электроотрицательности атома, например полусумму его сродства к электрону и потенциала ионизации (метод Малликена). Электроотрицательность элементов периодической системы, как правило, последовательно возрастает слева направо в каждом периоде. В пределах каждой группы, за несколькими исключениями, электроотрицательность последовательно убывает сверху вниз. С помощью электроотрицательностей можно охарактеризовать химическую связь. Чем больше разница электроотрицательностей атомов, образующих химическую связь, тем больше степень ионности этой связи. Связи при разности электроотрицательностей атомов больше 2,1 могут считаться чисто ионными (по данным других научных источников, 50%-й ионности связи соответствует разность электроотрицательностей атомов, равная 1,7). Связи с меньшей разностью электроотрицательностей атомов относят к полярным ковалентным связям. Чем меньше разность электроотрицательностей атомов, образующих химическую связь, тем меньше степень ионности этой связи. Нулевая разность электроотрицательностей атомов указывает на отсутствие ионного характера у образованной ими связи, т. е. на ее сугубую ковалентность.
Электроотрицательность атома, по-видимому, зависит и от степени его окисления. Так, для трех оксидов хрома: СrO, Сr2O3, СrO3– наблюдается изменение их характера от основного (CrO) через амфотерный (Сr2O3) до кислотного (СrO3). Один и тот же элемент – хром – в СrO ведет себя как типичный металл, в Сr2O3 – как амфотерный металл, а в СrO3 – как типичный неметалл.
При составлении химических формул соединений следует учитывать, что более электроотрицательные элементы помещаются правее, например, H2S, OF2, SCl2O, Br3N, SiBr2F2.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3866; Нарушение авторских прав?; Мы поможем в написании вашей работы!