
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимия. Электродные потенциалы
|
|
|
|
Лекция 15
1. Понятие об электрохимии. Атомы состоят из заряженных частиц – ядра (+) и электронов (–), но в целом они электронейтральны. Наличие электрических зарядов может оставаться не заметным. Но иногда мы сталкиваемся с электризацией. Причесываемся, но волосы на голове разлетаются. Одежда прилипает к телу, и даже слышится потрескивание электрических разрядов. В этом обнаруживается одно универсальное явление – возникновение электрических зарядов на границах раздела фаз. Соприкасающиеся поверхности иногда самопроизвольно, иногда при затрате работы (случай электризации трением) приобретают противоположные электрические заряды. Помимо очевидных примеров, поверхностные заряды оказываются причиной возникновения электрического тока в батарейках; работу термоэлементов; заряды на мембранах нервных клеток обеспечивают проведение нервных импульсов; заряды на нано-частицах стабилизируют дисперсные системы и т.д. Само название электричество возникло от способности янтаря к электризации (по-гречески hlektro – янтарь.)
Раздел физической химии, в котором изучается взаимосвязь химических и электрических явлений, называется электрохимия. Главными проблемами электрохимии являются возникновение электрических явлений при химических реакциях и протекание химических реакций при воздействии электричества.
Основателями электрохимии считаются два итальянских врача, Луиджи Гальвани (1737–1798, Болонья) и Алессандро Вольта (1745–1827). На корень гальвано в БМЭ имеется15 статей.
Гальванокаустика
Гальванизация
Гальванотропизм и т.д.
Название гальванический элемент происходит от фамилии Гальвани.
Электрохимическая система – гетерогенная система, в которой возникает электрический ток за счет самопроизвольной реакции (гальванический элемент) или идет несамопроизвольная реакция за счет затраты электрической работы (электролизер). Возможно двойное действие системы: в заряженном состоянии она действует как источник тока, а в процессе зарядки как электролизер. Такое устройство называется аккумулятор. Все любознательные это знают.
Электрохимическая реакция – реакция, сопровождающаяся переносом зарядов через границу раздела фаз.
2. Разновидности поверхностных потенциалов. В зависимости от природы соприкасающихся фаз различают несколько разновидностей поверхностных потенциалов.
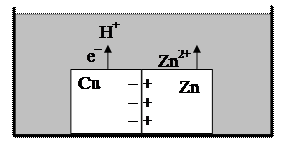
– Контактный потенциал возникает на границе раздела двух металлов. В случае контакта цинка и меди, цинк, легче отдающий электроны, заряжается положительно, а медь отрицательно. Избыточные заряды концентрируются по поверхности раздела металлов, образуя двойной электрический слой.

Если такой биметалл погрузить в кислоту, то электроны, восстанавливающие ионы Н+, уходят с поверхности меди, и при этом ионы цинка с поверхности металла переходят в раствор:
– Диффузионный потенциал возникает на границе раздела двух жидких электролитов. Это могут быть растворы одного вещества с разными концентрациями, или растворы разных веществ, или раствор и растворитель. Очевидно, что такая граница неустойчива. Происходит диффузия ионов, что и ведет к возникновению разности потенциалов. Предположим, что система состоит из растворов хлорида калия и хлороводорода одинаковой концентрации 1 моль/л. Происходит диффузия ионов K+ в раствор HCl и встречная диффузия ионов H+ в раствор KCl. Диффузия ионов водорода происходит с большей скоростью (направление показано более длинной стрелкой), в результате чего со стороны раствора KCl имеется избыток положительного заряда, а со стороны раствора кислоты – отрицательного. Возникает скачок потенциала φдиф.
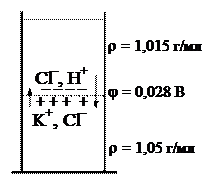
– Мембранный потенциал возникает на мембране, характеризующейся избирательной проницаемостью по отношению к ионам разной природы. Представим растворы хлорида разной концентрации, разделенные мембраной, пропускающей ионы хлора, но не пропускающей ионы натрия. Тогда некоторое количество ионов Cl– из раствора с большей концентрацией перейдет в раствор с меньшей концентрацией. Остающийся избыток ионов Na+ притягивает ионы Cl–, и останавливает перенос через мембрану. Устанавливается некоторый скачок потенциала, соответствующий состоянию равновесия.

– Электродный потенциал возникает на границе раздела металл (проводник 1-го рода) – электролит (проводник 2-го рода). Электродный потенциал имеет наибольшее значение в электрохимии, так как на этом явлении основана работа химических источников тока. Система, состоящая из металла и электролита называется электродом. Далее мы будем говорить о целом ряде разновидностей электродов. Сейчас в качестве примера рассмотрим ионно-металлический электрод (электрод 1-го рода) Cu / Cu2+. Пластина металлической меди погружается в раствор соли меди, например, CuSO4. Электрод условно записывается символом Cu | Cu2+, где под вертикальной чертой подразумевается поверхность раздела металла и электролита.

Концентрация ионов меди в металле и, соответственно, их химический потенциал выше, чем в растворе. Поэтому некоторое число ионов Cu2+ переходит с поверхности металла в электролит. На металле остается избыток электронов. Со стороны электролита к поверхности металла притягиваются ионы с положительными зарядами. Возникает двойной электрический слой (ДЭС). В результате движения ионов в растворе, некоторое число ионов удаляется от поверхности, находясь в диффузионном слое. Устанавливается равновесие значение скачка потенциала в двойном электрическом слое. Этот скачок потенциала j называют электродным потенциалом.
Рассмотрим, от чего зависит величина электродного потенциала. Разделение зарядов в ДЭС означает затрату электрической работы, а перенос частиц вещества в виде ионов с металла в раствор – самопроизвольный химический процесс, преодоэевающий электрическое противодействие. В состоянии равновесия
Wэл = –Wхим
Преобразуем это уравнение для одного моля ионов металла Mez+ (в нашем примере это Cu2+):
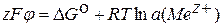 ,
,
где F – постоянная Фарадея 96485,3383 Кл·моль–1 (по новейшим данным). По физическому смыслу это заряд 1 моль элементарных зарядов. Активность ионов металла a (Me z +) в случае достаточно разбавленных растворов может быть заменена концентрацией с (Me z +). Делением написанного выражения на zF получаем уравнение для расчета электродного потенциала:
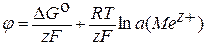 ,
,
При а (Меz+) = 1; j = jо = DG°/zF. Производим подстановку:
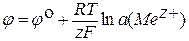
Это уравнение называется уравнением Нернста. Согласно этому уравнению, электродный потенциал зависит от активности (концентрации) ионов электролита a (Me z +), температуры Е и природы системы Ме/ Me z +, которая подразумевается в значении стандартного электродного потенциала jо.
Возьмем для сравнения другой электрод, получающийся погружением цинковой пластинки в раствор сульфата цинка, обозначаемый символом Zn|Zn2+:
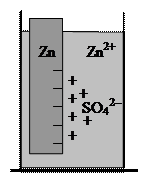
Цинк более активный металл, чем медь. С поверхности металла в электролит переходит большее число ионов Zn2+, а на металле остается больший избыток электронов (при прочих равных условиях). В результате оказывается, что
jо(Zn2+) < jо(Cu2+)
В известном вам ряду активности, металлы расположены в порядке повышения стандартных электродных потенциалов.
3. Гальванический элемент
Рассмотрим систему, составленную из двух электродов – медного и цинкового. Электролиты соединяются изогнутой трубкой, заполненной раствором хлорида калия. Через такой мостик ионы могут перемещаться ионы. Подвижности ионов K+ и Cl– практически одинаковы, и таким образом минимизируется диффузионный потенциал. Металлы соединяются медной проволокой. Контакт между металлами при необходимости можно размыкать. В цепь может быть также помещен вольтметр. Эта система представляет собой пример гальванического элемента, или химического источника тока. Электроды в гальваническом элементе называют полуэлементами.

При разомкнутом контакте между металлами на границах раздела металл-электролит устанавливаются равновесные значения электродных потенциалов. Химические процессы в системе отсутствуют, но между электродами имеется разность потенциалов
Δφ = jо(Cu2+) – jо(Zn2+)
При замкнутом контакте электроны начинают переходить с цинковой пластины, где их поверхностная концентрация больше и потенциал ниже, на медную пластину. Потенциал на меди понижается, а на цинке повышается. Равновесие нарушилось. На поверхности меди электроны реагируют с ионами в двойном электрическом слое, образуя атомы:
Cu2+ + 2e– = Cu
Потенциал на меди снова приближается к равновесному. На поверхности цинка недостаток электронов восполняется переходом ионов в двойной электрический слой, а из него в электролит:
Zn = Zn2+ + 2e–
Потенциал на цинке снова приближается к равновесному. Процессы на электродах поддерживают разность потенциалов между ними, и поток электронов не прекращается. В цепи идет электрический ток. В медном полуэлементе происходит осаждение меди на поверхности металла, и понижение концентрации ионов Cu2+ в растворе. В цинковом полуэлементе масса металла уменьшается, и одновременно увеличивается концентрация ионов Zn2+ в растворе. Гальванический элемент работает, пока замкнут проводник, и пока не израсходованы исходные компоненты – металлический цинк и соль меди. Складывая реакции, идущие на электродах, получаем суммарное уравнение реакции в гальваническом элементе:
Zn + Cu2+ = Zn2+ + Cu, Δr H = -218,7 кДж; Δr G = -212,6 кДж
Если эта же реакция проводится в обычных условиях между цинком и сульфатом меди, то вся энергия выделяется в виде теплоты, равной 218, 7 кДж. Реакция в гальваническом элементе дает электрическую работу 212,6 кДж, и на долю теплоты остается лишь 6,1 кДж.
Разность потенциалов между электродами в гальваническом элементе является измеряемой величиной, называемой электродвижущей силой, ЭДС. Это положительная величина:
ЭДС = |Δφ|
Потенциалы электродов и ЭДС элемента не зависят от размеров системы, а только от материалов и условий. Поэтому источники тока имеют различные размеры в зависимости от назначения, что мы видим по имеющимся в продаже батарейкам. Электроды для практических и научных измерений могут иметь микроразмеры, позволяющие вводить их в клетку для измерения мембранных потенциалов.
Рассмотренный гальванический элемент в стандартном состоянии имеет ЭДС = 1,1 В.
ЭДС = |jо(Cu2+/Cu) - jo(Zn2+/Zn)| = 1,1 В.
Применяется следующая условная запись гальванической цепи:
|
|
Анод – электрод, на котором идет окисление.
Катод – электрод, на котором идет восстановление.
Разность потенциалов электродов измеряется вольтметром, но электродный потенциал отдельного электрода экспериментально определить невозможно. Поэтому потенциал условно выбранного электрода принимают за ноль, и относительно него выражают потенциалы всех остальных электродов. В качестве нулевого электрода был взят стандартный водородный электрод. Он состоит из платиновой пластины, покрытой платиновой чернью, и опущенной в раствор кислоты, в которую пропускают водород под давлением 101,3 кПа. Электрод записывается следующим образом:
Pt, H2 |H+
По соглашению, jº(Pt, H2 | H+) = 0 В.

Если водородный электрод в изучаемом гальваническом элементе оказался катодом, то второй электрод в этом элементе – анод, и его потенциал отрицательный. В противоположном случае, когда водородный электрод оказался анодом, у второго электрода потенциал положительный (катод). В ряду активностей металлов водород находится между металлами с отрицательными и положительными стандартными потенциалами. Стандартные электродные потенциалы, выраженные относительно водородного электрода, приводятся в таблицах. Мы можем по таблице найти потенциалы и вычислить ЭДС медно-цинкового гальванического элемента:
jо(Cu2+/Cu) = +0,34 В; jo(Zn2+/Zn) = –0,76 В; ЭДС = 0,34 В – (–0,76 В) = 1,1 В.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5247; Нарушение авторских прав?; Мы поможем в написании вашей работы!