
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: макроскопічний стан
|
|
|
|
Лекція VII
ПЛАН
1. Статистичний та термодинамiчний методи, макроскопiчнi параметри.
2. Основне рiвняння молекулярно-кiнетичної теорiї. Рiвняння стану iдеального газу.
3. Середня кiнетична енергiя молекул. Молекулярно-кiнетичний змiст температури.
4. Закон рiвномiрного розподiлу енергiї за ступенями вiльностi.
1. Статистична фiзика вивчає властивостi та агрегатнi стани макроскопiчних тiл залежно вiд їх будови й взаємодiї мiж їх частинками (атомами i молекулами) i параметрами їх теплового руху.
Термодинамiка - це роздiл фiзики, який вивчає найбільш загальнi властивостi макросистем, якi знаходяться в рiвновазi, та процеси переходу мiж ними.
У статистичнiй фiзицi використовується молекулярно-кiнетичний метод дослiджень. Вiн установлює закони протiкання рiзних процессiв у макротiлах на основi вивчення їх молекулярної структури і механiзму взаємодiї окремих молекул.
Термодинамiка (термодинамiчний метод) - використовується для вивчення властивостей тiл без урахування їх внутрiшньої будови. Його основна мета - визначення стану термодинамiчної системи.
Термодинамiчна система - це сукупнiсть макротiл, якi взаємодiють та обмiнюються енергiєю мiж собою і зовнiшнiм середовищем.
Стан кожної термодинамiчної системи задається термодинамiчними параметрами.
Термодинамiчнi параметри - це сукупнiсть фiзичних величин, якi характеризують властивостi термодинамiчної системи: P,V,T.
Абсолютна температура - це величина, яка характеризує термодинамiчну рiвновагу системи.
Термодинамiчний рiвноважний стан - це такий стан, при якому всi термодинамiчнi параметри не змiнюються з часом.
Термодинамiчний процес - явище переходу системи iз одного термодинамiчного стану в iнший.
2. Найпростіший об'єкт дослідження у молекулярній фізиці - ідеальний газ.
Iдеальний газ - це газ, молекули якого можна вважати матеріальними точками, та можна знехтувати взаємодiєю мiж його молекулами.
Знайдемо рiвняння, яке б зв'язувало залежнiсть параметрiв стану газу з кiнетичною енергiєю поступалього руху його молекул.
Із найбільш загальних мiркувань тиск визначається наслiдком ударiв молекул об стiнку посудини з деякою силою, величина якої невiдома. Однак ми можемо порахувати середню силу, яка дiє на стiнку посудини з боку усiх молекул газу.


 Z l
Z l




 | |||
 | |||



 N
N

 Y
Y

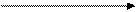
 O
O
 |
Х
Маємо газ, який знаходиться у кубi з довжиною ребра l, кiлькiсть молекул N, уздовж кожної гранi рухається N1 молекул;  зi швидкiстю
зi швидкiстю 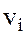 .
.
Сила дiї одної молекули на грань
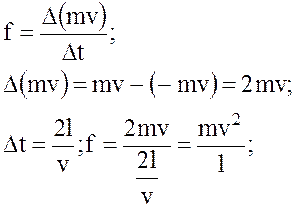
а повна сила всiх N1-молекул на грань l дорiвнює:
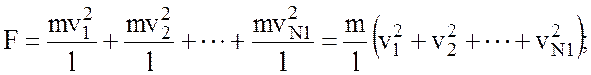
Уведемо середню квадратичну швидкiсть поступального руху молекули газу:


Уведемо середню кiнетичну енергiю поступального руху однiєї молекули газу:
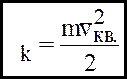 (*)
(*)
 (1)
(1)
- основне рiвняння МКТ.
Тиск в ідеальному газовi дорiвнюї 2/3 добутку середньокiнетичної енергiї поступального руху молекули газу на концентрацiю молекул газу.
Це рівняння основне тому, що пов`язує макропараметри з мікрохарактеристиками газу (швидкість однієї молекули).
Воно дає відповідь на питання, чому в газі є тиск. Тому, що молекули володіють кінетичною енергією, б’ють із силою на грані куба і зумовлюють тиск.
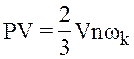
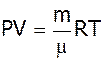
Тому рівняння Клапейрона-Менделєєва є звичайним наслідком основного рівняння молекулярної теорії.
3. Ми знайшли, що
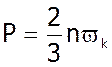 ;
; 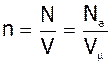 ,
,
де 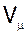 - об`єм одного моля газу;
- об`єм одного моля газу;
Nа - стала Авогадро; 6.023 1013 моль-1 - величина, яка показує кількість молекул, що знаходяться в одному молі газу.
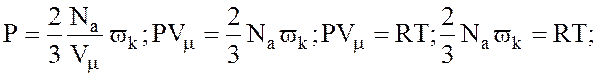
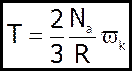 (2)
(2)
Т є мірою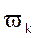 поступального руху молекул газу.
поступального руху молекул газу.
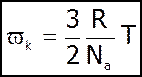
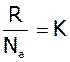 - стала Больцмана; К=1.38*10-23 Дж/К.
- стала Больцмана; К=1.38*10-23 Дж/К.
 (3)
(3)
- кінетична енергія поступального руху однієї молекули.
Порівнявши (3) і (*), будемо мати:

Другий варіант формули одержимо з урахуванням:
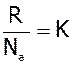 та
та 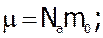
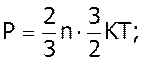
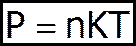 (4)
(4)
Цей вираз є одним із варіантів запису основного рівняння МКТ.
4. Молекули газу можна розглядати як систему матеріальних точок, які здійснюють як поступальний, так і обертальний рух.
Кількість незалежних координат, які визначають положення молекул у просторі, називають кількістю ступенів вільності молекул.
Одноатомний газ (аргон,...): i = 3
Двоатомний газ (NО,CО,H2): i = 5
Триатомний газ та багатоатомний: і = 6 (3 поступальних та 3 обертальних степенів вільності).
Для поступального руху молекул ми знайшли, що
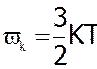 , а оскільки поступальному рухові завжди відповідає 3 степені вільності, то на кожний ступінь вільності припадає
, а оскільки поступальному рухові завжди відповідає 3 степені вільності, то на кожний ступінь вільності припадає 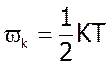 .
.
У цьому і є зміст закону рівномірного розподілу енергії за степенями вільності:
Статистично, в середньому, на кожний ступінь вільності молекули припадає енергія 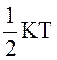
В однорідному багатоатомному газі кожна молекула має
і-ступенів вільності, тому кожна молекула володіє енергією:
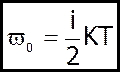 (5)
(5)
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!