
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: основи термодинаміки
|
|
|
|
Лекція IX
ПЛАН
1. Внутрiшня енергiя.
2. Теплота i робота.
3. Перший початок термодинамiки.
4. Теплоємнiсть багатоатомних газiв.
5. Адiабатичний процес. Рiвняння Пуассона.
6. Оборотнi та необоротнi процеси. Цикл.
7. Цикл Карно і його коефiцiєнт корисної дiї.
8. Другий початок термодинамiки. Ентропiя.
1. Кожна термодинамічна система характеризується повною енергiєю, в яку входять:
1) кінетична енергія механічного руху системи як цiлого у просторi або її макрочастинок;
2) потенціальна енергія, яка залежить вiд положення системи в зовнiшньому силовому полi;
3) внутрiшня енергiя U, яка залежить вiд внутрiшнього стану системи.
Внутрішня енергія мiстить у собi:
1) кінетичну енергію поступального та обертального руху молекул;
2) потенціальну енергію їх взаємодiї;
3) енергiю коливального руху молекул, електронних оболонок і ядер.
Слiд сказати, що внутрішня енергія є функцiєю параметрiвстану системи (перехiд системи з одного стану в iнший не залежить вiд способу переходу цiєї системи з одного стану в iнший).
 для даної маси.
для даної маси.
В iдеальному газi потенціальна енергія взаємодiї молекул дорiвнює 0. У термодинаміцi не враховується внутрiшньомолекулярна та внутрiшньоядерна енергiя, тому внутрішня енергія iдеального газу однозначно повинна дорiвнювати кінетичній енергії молекул.
Нам відомо, що для однієї молекули 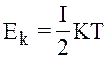 ;
;
а для одного моля 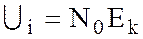 ;
;
 ;
; 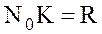 ;
;
 - внутрiшня енергiя одного моля iдеального газу.
- внутрiшня енергiя одного моля iдеального газу.
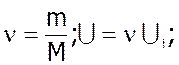
 - внутрiшня енергiя iдеального газу.
- внутрiшня енергiя iдеального газу.
2. Змiна стану системи зумовлена передачею енергiї вiд одного тiла системи до iншого, а передача енергiї вiдбувається або у формi виконаної механічної роботи А, або у формi передачi теплоти Q.
Kiлькiсть теплоти Q - це фiзична величина, яка чисельно дорiвнює кiлькостi енергiї, що передається вiд одної системи до iншої внаслiдок теплообмiну.
Вiдомо, що теплота Q i робота А як двi форми передачi енергiї тiсно пов`язанi одна з одною. Одержимо вираз для роботи А при розширеннi газу:
dh























































 газ
газ 

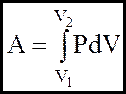 (2)
(2)
Якщо А>0, то газ звершує роботу при розширеннi.
Якщо А<0, то робота звершується над газом, унаслiдок чого вiн стискується.
Розглянемо вираз для роботи для рiзних iзопроцеciв:
1). i зохоричний: V = const; dV = 0;

2). iзобаричний:
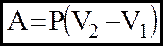
3). iзотермiчний:
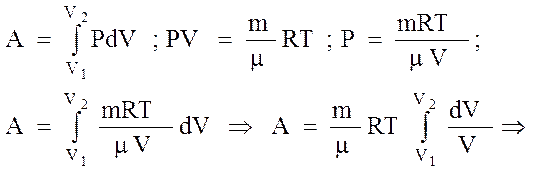
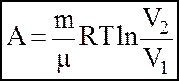
3. Перший початок термодинаміки зумовлює закон збереження та перетворення енергiї стосовно теплових процесiв i формулюється так:
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 254; Нарушение авторских прав?; Мы поможем в написании вашей работы!