
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: будова атома. Теорія Бора
|
|
|
|
ЛЕКЦІЯ ХХI
ПЛАН
1. Досліди Резерфорда з розсіяння a- частинок. Ядерна модель атома.
2. Атом водню та його спектр із теорії Бора.
3. Суцільний рентгенівський спектр і його короткохвильова межа.
4. Лінійчастий рентгенівський спектр. Закон Мозлі.
1. У другій половині минулого століття відкриття в різних галузях науки (періодичний закон Менделєєва, рентгенівські промені, радіоактивність) поставили під сумнів існуючі раніше уявлення про атом як неподільну частку.
 |
+
 S
S



 *
*
a=180°
Основою сучасних уявлень про будову атома є досліди Резерфорда з розсіювання a-частин при проходженні через золоту фольгу. Із неспроможності пояснити ефект відхилення a-частин на основі існуючих уявлень, Резерфорд теоретично розв’язав задачу про розсіяння частинок у кулоновському полі, яке складалось із Р позитивних зарядів. Порівняльний аналіз результатів експериментів та розрахунків дозволив установити:
1) P = Z, де Z - порядковий номер елемента у таблиці Менделєєва.
2) В атомі містяться Z-електронів.
Було запропоновано ядерну модель атома: у середині атома існує позитивний центр - ядро атома, навколо якого рухаються електрони, причому розміри ядра» 10-15 м, а діаметр атома ≈ 10-10 м.
å me << mядра





 + -
+ -
 | |||
 |
10-15 м
 |

Але ядерна модель не в змозі була пояснити два питання відповідно до законів класичної електродинаміки:
1) електрон повинен був випромінювати безперервну електромагнітну хвилю, але експеримент указує на те, що спектри випромінювання атомів дискретні.
2) випромінюючи електромагнітну хвилю, електрон повинен, втрачаючи енергію, згодом “впасти на ядро”, але атоми дуже стійкі.
Що ж відбувається насправді!?
2. Вивчаючи лінійчасті спектри атома водню, Бальмер у 1865 році встановив формулу для знаходження n або l у спектрі атома водню.
 (1)
(1)
с = 3. 108 м/с - швидкість світла у вакуумі,
R = 1,097 . 107 м-1 - стала Рідберга,
n = 3, 4, 5...
Усі лінії спектра, які відзначаються різним n, утворюють серію ліній. Узагальнуючи одержаний результат, Рідберг установив, що існують й інші серії ліній, а загальна формула для їх опису має вигляд:
 Є (2)
Є (2)
n - номер орбіти (рівня), з якої “зникає” електрон,
к - номер рівня, на якому він з’являється.
к = 1,2; 3,4.
n = к+1; к+2.
к, n - номери орбіт електронів у вакуумі.
(1) і (2) - формули для розрахунку частоти випромінювального світла.
Напишемо характерні існуючі серії:
Якщо к = 1 n = 2,3... Лайман (УФ-область)
к = 2 n = 3,4... Бальмер (видима область)
к = 3 n = 4,5... Пашен (ІЧ-область)
к = 4 n = 5,6... Брег(ІЧ-область)
к = 5 n = 6,7... Пфунд(ІЧ-область)
к = 6 n = 7,8... Хемфрі(ІЧ-область)
Для воднеподібного іона (іон з одним електроном) формула (2) переходить:
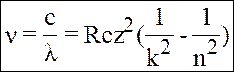 (3)
(3)
Z - заряд ядра.
Однак ці експерименти знаходились у суперечності з класичними уявленнями про рух електрона в атомі, що і привело до створення некласичної (напівквантової) теорії Бора (1910 р.), яка певним чином на той час дозволила узгодити:
1) емпиричні закономірності лінійчастих спектрів,
2) ядерну модель атома,
3) квантовий характер випромінювання та поглинання світла атомами.
У теорії Бора поведінка електрона в атомі “регулюється” трьома постулатами:
I. (Для стаціонарних станів): Існують такі стаціонарні стани для атомів, у яких атом не випромінює і не поглинає енергії. Це відповідає руху електрона по відповідній орбіті.
II. Правило квантування орбіт: У стаціонарному стані електрон рухається по орбіті, рівняння якої має такий вигляд:
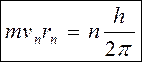 (4)
(4)
n = 1, 2, 3...
vn - швидкість електрона масою m по орбіті радіуса rn із номером n.
h - 6,626. 10-34 Дж.с -стала Планка.
 |
III. Правило частот. При переході електрона в атом із однієї орбіти на іншу атом або поглинає, або випромінює квант енергії Е = hn, який дорівнює в точності різниці енергії рівнів атомів у цих стаціонарних станах.
Опишемо математично рух електрона в атомі:
m.aд.ц. = Fкул.; ад.ц. = vn2 / rn
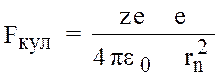
 (6)
(6)
Спільне рішення (6) і (4) дає
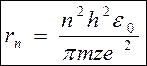 (7)
(7)
Для атома водню n = 1, Z = 1.
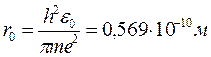
- перший боровський радіус (збігається з висновками ядерної моделі Резерфорда).
Повна енергія електрона в атомі:
 (з урахуванням (6))
(з урахуванням (6))
Підстановка із (7) rn у цей вираз дає
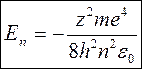 (8)
(8)
Одержали дискретні (квантові) енергії електрона в атомі.
n - квантове число,
n = 1 - головний стан,
n > 1 - збуджений стан.
При n®¥ и іонізація атома.
 |
φі потенціал іонізації

H: n = 1; Z = 1; ji = -13,59 eV.
Тепер стало зрозумілоими спектральні особливості атома водню.
3. Рентгенівські промені були відкриті Рентгеном у 1895 р. і являють собою жорстке короткохвильове випромінювання, яке виникає внаслідок гальмування прискорених електронів.
 вакуум
вакуум
 р. промені
р. промені


 А К
А К

 e
e
 -
-
~
кВ
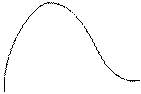
Експерименти показали, що при енергіях електронів, які не перевищують деяких критичних значень, визначених властивостями речовини анода, виникає суцільний рентгенівський спектр. Це випромінювання імітується самими електронами.
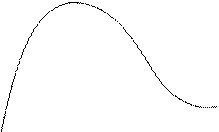


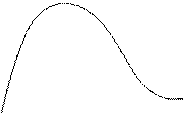 j3 j3 > j2 > j1
j3 j3 > j2 > j1
 |
j2
j1
 |
l min l
Це випромінювання буде обмежено з боку довжин хвиль або частот (lmin,nmax).
j - потенціал, який подається на електрод рентгенівської трубки.
На основі збереженої енергії маємо:
hnmax = Wк
hnmax - енергія рентгенівського кванту,
Wк - кінетична енергія електрона.
Wк = еj
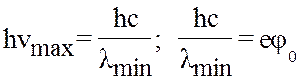
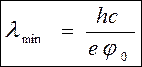 (9)
(9)
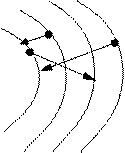
5. Поряд із гальмовим випромінюванням існує характеристичне рентгенівське випромінювання, яке характеризує речовину анода. Воно має не суцільний, а лінійчастий спектр.
 | |||
 | |||
+Ze
 (np фотон)
(np фотон)
K L M N
При віддаленні електрона з К оболонки і вище на вільне місце приходить електрон, що супроводжується випромінюванням рентгенівського фотона, частота якого визначається законом Мозлі:
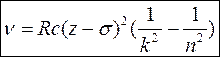 (10)
(10)
s - стала екранування, яка визначається фізико-хімічними властивостями речовини анода.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 911; Нарушение авторских прав?; Мы поможем в написании вашей работы!