
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотные свойства, образование ацетиленидов
|
|
|
|
Химические свойства алкинов
По Бренстеду-Лоури кислота – соединение, способное отдать протон (Н+), а кислотность – мера склонности кислоты к такому процессу. Высокая кислотность характерна для веществ, в которых водород связан с сильно электроотрицательным атомом, чаще всего с кислородом, галогеном, серой, азотом. В этом случае электронная плотность связи сильно сдвинута в сторону гетероатома, что приводит к легкому отщеплению протона. Кроме того, электроотрицательный элемент после отщепления протона лучше удерживает пару электронов, что приводит к увеличению стабильности образующегося аниона и, следовательно, к большей кислотности. При рассмотрении электроотрицательности в ряду F > O > N > C не вызывает удивления, что HF - достаточно сильная кислота, H2O значительно слабее, NH3 чрезвычайно слабая, а СН4 вообще не считают кислотой, поскольку нет оснований, способных оторвать протон от алкана.
Как сам ацетилен, так и его гомологи с концевой тройной углерод-углеродной связью являются слабыми СН-кислотами, способными быть донорами протона при взаимодействии с сильными основаниями. Например, в реакции ацетилена с металлическим натрием или амидом натрия образуется ацетиленид натрия.
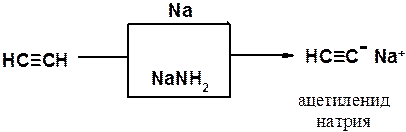
Алкины проявляют кислые свойства только в апротонных безводных растворителях. Это объясняется тем, что кислые свойства ацетиленовых углеводородов с концевой тройной связью выражены значительно слабее, чем у воды, а связь углерод-металл ближе к ионной, чем к ковалентной. Вода мгновенно гидролизует ацетилениды щелочных металлов.
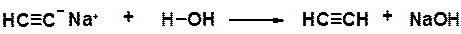
Связь С-Н в алкинах образована за счет перекрывания 1 s электрона атома водорода и орбитали углерода, находящегося в sp-гибридизованном состоянии. Такой углеродный атом проявляет большую электронную акцепторность, чем sp 2- и sp 3-гибридизованные атомы и лучше удерживает электроны. В сравнении с sp 3-орбиталью, sp-орбиталь обладает более выраженным s характером: она меньше по размеру (см. Введение) и электрон лучше удерживается атомом. В результате ацетиленид-анион, пара электронов которого находится на sp -орбитали, обладает большей относительной устойчивостью (имеет меньшую энергию), чем винильный или алкильный катион.

Кроме ацетиленидов щелочных металлов в синтезе часто используют магниевые производные, получаемые реакцией алкинов с реактивами Гриньяра (реактивы Ж.Иоцича).
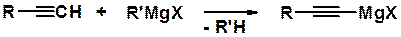
Во многих случаях реактивы Иоцича более удобны в синтезе, чем ацетилениды щелочных металлов. Обладая высокой реакционной способностью, они заметно более устойчивы, с ними проще проводить реакции.
Алкины с концевой тройной связью могут реагировать с ионами тяжелых металлов с образованием соответствующих ацетиленидов. Так, ацетилен и его гомологи реагируют с аммиачным раствором оксида серебра или хлорида одновалентной меди с образованием соответствующих ацетиленидов.
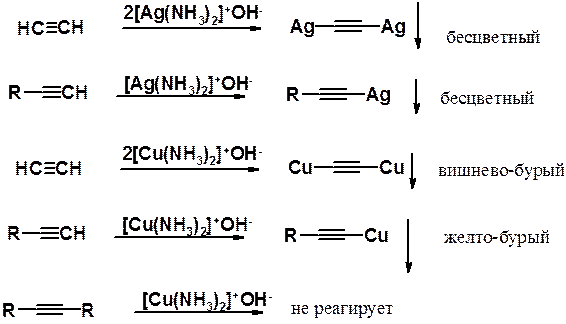
В ацетиленидах тяжелых металлов связь металл-углерод намного менее полярна, чем в производных щелочных металлов. Эти соединения в водных растворах выпадают в осадок. Образование осадка ацетиденида серебра или меди часто используют как качественную реакцию на концевую тройную связь. Если тройная связь находится в глубине цепи, образования ацетиленида (выпадение осадка) не происходит. При работе с ацетиленидами тяжелых металлов следует соблюдать особые меры предосторожности, поскольку эти вещества взрывоопасны.
Реакция с карбонильными соединениями. Ацетилен, как и алкины с концевой тройной связью, в присутствии щелочей реагируют с карбонильными соединениями (альдегидами и кетонами) с образованием ацетиленовых спиртов. Взаимодействие ацетилена с ацетоном (реакция Фаворского):
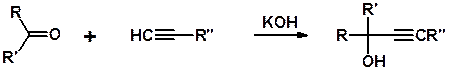
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1507; Нарушение авторских прав?; Мы поможем в написании вашей работы!