
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Уже само название «циклоалканы» говорит о свойствах соединений
|
|
|
|
Уже само название «циклоалканы» говорит о свойствах соединений. Как и для алканов, для циклоалканов характерны реакции свободнорадикального замещения. Хлорирование циклогексана на свету приводит к смеси от моно- до пер -замещенных хлорциклогексанов.
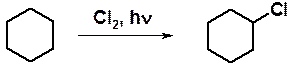
Далее рассмотрены специфические реакции циклоалканов. Реакционная способность этого класса органических веществ существенно зависит от размера цикла. Вообще циклоалканы делят на 4 группы:
· с малыми циклами (С3 и С4);
· с обычными циклами (С5 – С7);
· со средними циклами (С8 – С12);
· с большими циклами (> С12).
Начиная с циклопентана циклоалканы не демонстрируют каких-либо особенностей химического поведения.
Иначе с малыми циклами. Циклопропан и его гомологи вступают в реакции присоединения. Говорят о «ненасышенности малых циклов».
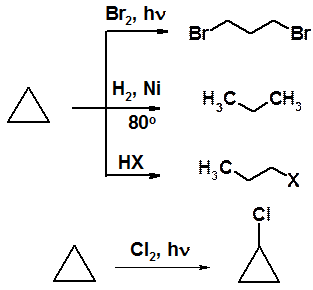
Каталитическое гидрирование, бромирование на свету и реакция с галогеноводородами приводят к производным пропана. Свободнорадикальное хлорирование дает продукт замещения. Других реакций присоединения нет.
Циклобутан гидрируется значительно труднее, в более жестких условиях.
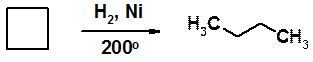
Объяснения имеющимся фактам различной устойчивости циклов разного размера были высказаны А. Байером (Мюнхен). В 1885 г. он предложил теорию напряжения. Сегодня она частично отвергнута, но частично может быть использована.
А. Байер заметил, что в циклоалканах валентные углы отклоняются от стандартных значений, что приводит к возникновению напряжения в циклах.
Байер выразил угловое напряжение в циклоалканах половиной разницы валентного угле и внутреннего угла многоугольника. Для циклопропана:
| 109о28’ – 60o | = 24o44’ |
Угловое напряжение в циклобутане – 9о44’, в циклопентане – 0o44’, в циклогексане – -5о16’, в циклогептане – -9о33’. Далее, с увеличением размера цикла, напряжение растет. В XIX веке было известно о ненасыщенности малых циклов, устойчивости обычных циклов, а циклы большого размера не были получены. Считали, что их не удается получить из-за большого углового напряжения. На самом деле их просто не умели синтезировать.
Напряжение в циклах приводит к увеличению энергии (уменьшению стабильности) молекулы. Энергию циклоалканов очень удобно сравнивать по их очень точно определенным теплотам сгорания. Причем не в абсолютных величинах, а по теплоте сгорания на одно СН2-звено. Большие величины говорят о большей энергии.
Таблица 16.1.
Теплоты сгорания циклоалканов
| Соединение | DHCH2 (ккал/моль) |
| ациклические углеводороды | 157,4 |
| циклопропан | 166,6 |
| циклобутан | 164,0 |
| циклопентан | 158,7 |
| циклогексан | 157,4 |
| циклогептан | 158,3 |
| циклооктан | 158,6 |
| циклододекан | 157,6 |
| циклогептадекан | 157,2 |
Как видно из табл. 1, энергия сгорания циклоалканов, начиная с циклопентана, близка к значениям к энергии открытоцепных производных, не имеющих углового напряжения. Циклопропан и циклобутан действительно богаты энергией. Рассмотрим строение циклоалканов на примере циклогексана. По Байеру угловое напряжение в циклогексане больше, чем в циклопентане, хотя в реальной молекуле циклогексана углового напряжения нет. Все углы имеют стандартные значения, т.к. атомы углерода расположены не планарно (а Байер считал все циклы плоскими). Оказывается, существуют две конформации циклогексана, не имеющие углового напряжения, – «ванна» («лодка») и «кресло».
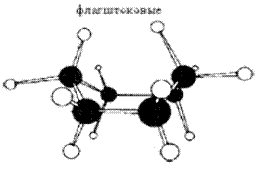
ванна кресло
Рис. 16.1. Конформации «ванна» и «кресло» циклогексана
Эти конформации неравноценны по энергии. В конформации «ванна» флагштоковые водороды расположены слишком близко друг к другу. Они отталкиваются, искажая ванну. Кроме того, группировки по бортам «лодки» находятся в заслоненной конформации. Такие группы стремятся за счет торсионного напряжения перейти в заторможенную конформацию. Все вместе это приводит к образованию твист -конформации, которая устойчивее «ванны» на 1,5 ккал.
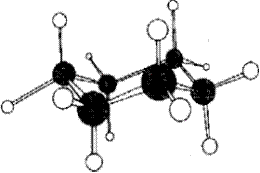
твист-
Рис. 16.2. твист -Конформация циклогексана
В конформации «кресло» отсутствуют флагштоковые водороды и их отталкивание. Кроме того, все СН2-группы находятся в заторможенной конформации, что дает выигрыш в энергии. Конформация «кресло» на 5,5 ккал/моль устойчивее твист -конформации и на 7 ккал/моль – «ванны».
В конформации «кресло» 6 атомов водорода перпендикулярны усредненной плоскости кольца и называются аксиальными (a-), а 6 других находятся близко к этой условной плоскости и называются экваториальными (e-). Если заместить один из водородов на алкильную или какую-нибудь функциональную группу, она может находиться в экваториальном или аксиальном положении. При комнатной температуре существует единственный циклогексан, а не два изомера. Причина этого – быстрая инверсия цикла, в результате которой метильная группа из аксиальной становится экваториальной.
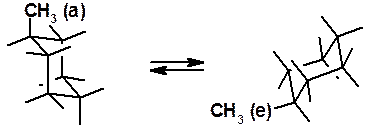
Рис. 16.3. Инверсия метилциклогексана
Циклопентан по Байеру практически не имеет углового напряжения. Однако даже он существует не в планарной форме, т.к. в плоской молекуле все атомы водорода будут находиться в заслоненной конформации, что приведет к заметному торсионному напряжению. Энергетически более выгодно существование циклопентана в виде так называемого «конверта», в котором 4 атома углерода находятся в одной плоскости, а пятый выходит из нее.
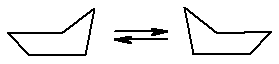
Рис. 16.4. Конформационные изменения циклопентана
Циклобутан также неплоский, он представляет собой два равносторонних треугольника, соединенных по одной из сторон и располагающихся в разных плоскостях. Причина выхода двух атомов углерода из плоскости все в той же заслоненной конформации метиленовых групп, которая энергетически невыгодна.
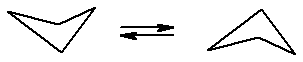
Рис. 16.5. Конформационные изменения циклобутана
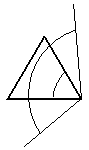
В циклопропане атомы углерода не могут находиться в разных плоскостях (геометрическое место трех точек – плоскость). Молекулу можно представить как правильный треугольник. Однако экспериментальные данные показывают, что циклопропан ведет себя так, как если бы угол между С-С связями составлял 102о. Невозможно представить себе правильный треугольник с внутренними углами не равными 60о.
Перекрывание атомных гибридизованных орбиталей в молекуле циклопропана показано на рис. 16.6. Как видно, связь образуется не по линии, связывающей центры атомов. Такие связи называют «банановыми» или изогнутыми. По своим характеристикам они занимают промежуточное положение между s- и p-связями. Этот факт объясняет частичную ненасыщенность циклопропана.
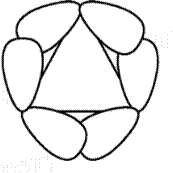
Рис. 16.6. Перекрывание атомных орбиталей в молекуле циклопропана
Некоторые алициклические производные широко используются в промышленности. В первую очередь это относится к производным циклогексана. Исходным сырьем для синтеза многотоннажных продуктов служит циклогексанон, получаемый в промышленности из доступного фенола.
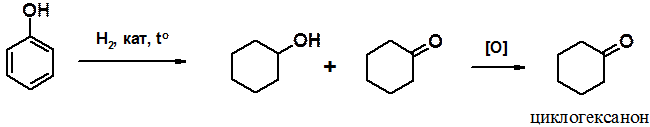
Каталитическое гидрирование фенола приводит к смеси циклогексанола и циклогексанона, которую, без предварительного разделения, окисляют, получая циклогексанон.
Два основных направления использования циклогексанона:
1. В присутствии окислителей циклогексанон легко превращается в адипиновую кислоту, которую затем вводят в реакцию поликонденсации с гексаметилендиамином с целью получения найлона:
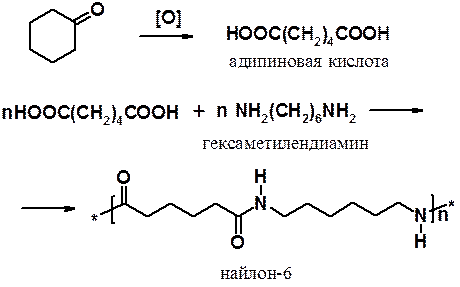
2. Реакция циклогексанона с гидроксиламином приводит к оксиму циклогексанона. Последний под действием серной кислоты претерпевает перегруппировку Бекмана, превращаясь в капролактам, который гидролизуют, получая e-аминокапроновую кислоту. Поликонденсация аминокапроновой кислоты приводит к капрону.
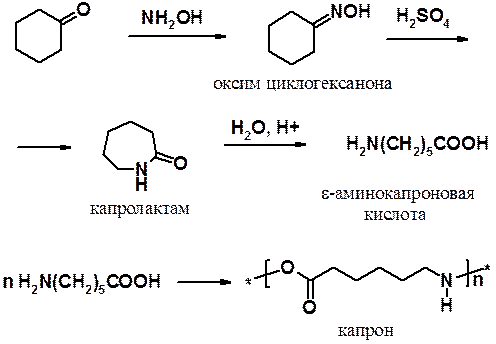
Из непредельных соединений алициклического ряда следует отметить одно вещество – циклопентадиен-1,3. Это вещество будет рассмотрено в разделе ароматические углеводороды. Здесь следует отметить следующее:
· Циклопентадиен существует в виде димера, который образуется в результате реакции Дильса-Альдера. Для получения самого циклопентадиена димер перегоняют.

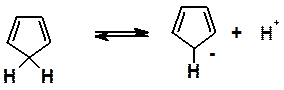
· Циклопентадиен необычайно легко отдает протон (проявляет высокую кислотность), что совершенно не характерно для углеводородов (причины этого будут рассмотрены в следующем разделе).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 807; Нарушение авторских прав?; Мы поможем в написании вашей работы!