
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Распределение электронов по оболочкам
|
|
|
|
| Значение n | Обозначение | Оболочки | Максимальное число электронов | ||||
| s | p | d | f | g | |||
| K | - | - | - | - | |||
| L | - | - | - | ||||
| M | - | - | |||||
| N | - | ||||||
| O | |||||||
| … |
Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния. В итоге, все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией. Примером может служить невозбуждённый атом лития (Li), у которого два электрона находятся на 1 s орбитали (самой низкой по энергии), при этом у них отличаются собственные моменты импульса, и третий электрон не может занимать 1 s орбиталь, так как будет нарушен принцип запрета Паули. Поэтому, третий электрон занимает 2 s орбиталь, т.к. эта орбиталь соответствует следующему по возрастанию значению энергии.
По мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит не только от главного квантового числа n, но и от l. Взаимодействие между электронами приводит к резко усложнённой энергетической последовательности атомных орбиталей, заселяющихся электронами. Поэтому в реальных многоэлектронных атомах картина энергетического распределения орбиталей оказывается очень сложной.
Порядок заполнения электроннных слоёв (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одной электронной оболочки (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется правилом Хунда. При этом на каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина).
Правило Клечковского (или, как иногда говорят, правило n + l) - эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах. Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел: n+l. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n. (Это правило предложено в 1936 г. немецким физиком Э. Маделунгом, а в 1951 г. было вновь сформулировано советским физиком В. М. Клечковским.)
Замечание. Эмпирическое правило Клечковского и вытекающая из него схема очерёдностей заполнения электронами орбиталей в атоме нарушаются у некоторых атомов (Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au), когда имеет место “провал” электрона с s -подуровня внешнего слоя на d -подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6 s следующий электрон появляется на орбитали 5 d, а не 4 f, и только затем происходит заселение четырнадцатью электронами 4 f орбиталей, затем продолжается и завершается заселение десятиэлектронного состояния 5 d. Аналогичная ситуация характерна и для орбиталей 7 s, 6 d и 5 f.
Правило Хунда (Фридрих Хунд (Friedrich Hund) - немецкий физик) определяет порядок заполнения орбиталей определённой оболочки и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Это означает, что каждая из орбиталей оболочки заполняется сначала одним электроном, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
С точки зрения квантовой механики электронная конфигурация - это полный перечень одноэлектронных волновых функций, из которых с достаточной степенью точности можно составить полную волновую функцию атома (в приближении самосогласованного поля). Т.к. все состояния являются вырожденными по квантовому числу m и по спину, то принято указывать только полное количество электронов, находящихся в состоянии с данными n, и l.
Слева от числа l пишут число n, а сверху от числа l - число электронов в состоянии с данными n, l. Например: 2 s 2 соответствует двум электронам в состоянии с n = 2, l = 0. Из-за практического удобства в полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа n, а затем квантового числа l, например: 1 s 22 s 22 p 63 s 23 p 2. (Иногда формулу сокращают до 1 s 22 s 2 p 63 s 2 p 2, т.е. опускают число n там, где его можно угадать из правила упорядочения термов).
Пример.
| Элемент | Терм основного состояния | Электронная конфигурация | |
| H | Водород | 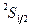
| 
|
| He | Гелий | 
| 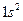
|
| Li | Литий | 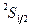
| 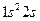
|
| Be | Бериллий | 
| 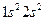
|
| Ne | Неон | 
| 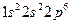
|
| Ar | Аргон | 
| 
|
| Fe | Железо | 
| 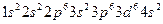
|
Валентная оболочка - самая внешняя оболочка атома. Электроны этой оболочки часто называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. Хотя это и не совсем верно. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
Периодическая система элементов.
Опыт показывает, что свойства атомов (и химические, и физические) зависят от зарядового числа, т.е. от количества протонов в ядре этого элемента. При этом по мере возрастания зарядового числа наблюдается повторяемость или периодичность свойств атомов. Это явление называется периодическим законом химических элементов. Чтобы показать повторяющиеся свойства химических элементов, их упорядочивают в виде периодической таблицы (таблицы Менделеева).
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) - классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. В современном варианте периодическая система представляет собой двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.
Химические свойства атомов определяются конфигурацией электронной оболочки. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов. Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2577; Нарушение авторских прав?; Мы поможем в написании вашей работы!