
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Двигательная функция белков
|
|
|
|
Для минимизации объемов запасов ЛС должна быть организована таким образом, чтобы держать под контролем величину связанных активов и их оборачиваемость в масштабах всей фирмы, а не только на каждом отдельном предприятии.
4. Консолидация перевозок. Транспортные издержки одни из самых крупных. Их величина непосредственно связана с типом груза, размером отправки и дальностью грузоперевозки. Для снижения издержек транспортировки желательно добиться консолидации перевозок за счет объединения отдельных грузов. Как правило, чем крупнее перевозимый груз и чем больше дальность перевозки, тем ниже транспортные расходы в расчете на единицу груза. Это требует разработки специальных программ по комплектованию мелких грузов в партии для укрупнения грузоперевозок. Реализации таких программ способствуют временные соглашения между разными участниками логистической цепочки.
5. Качество. (Непрерывное совершенствование качества). Если потребителю доставляется поврежденный продукт и не соблюдаются условия сервиса, то логистика едва ли создает добавленную стоимость. В то же время логистические издержки трудно подлежат возврату. Поддерживать «нулевой» уровень брака в логистике усложняется громадными географическими масштабами и непрекращающейся деятельностью днем и ночью.
6. Поддержка жизненного цикла. Лишь немногие товары могут быть проданы без какой либо гарантии того, что в течение определенного времени они будут соответствовать рекламируемым характеристикам. Иногда нормальное движение запасов, в котором создается добавленная стоимость, вынуждено обращаться вспять (т.е. возврат товара, случай с лекарством). Это требует специальных навыков и затрат. Надежная логистическая стратегия не может быть разработана без учета таких обратных потоков (например, возврат тары, потенциально опасных продуктов и т.п.).
Некоторые продукты требуют послепродажного обслуживания. От компаний, занимающихся продажей потребительских товаров длительного пользования или промышленного оборудования, обязательно требуется разносторонняя поддержка жизненного цикла, которая и формирует крупнейший элемент всех издержек логистики.
В современном понимании поддержка жизненного цикла продукта – это логистическое сопровождение от первого до последнего шага. Это включает обратные потоки и переработку материалов, послепродажное обслуживание, возврат товаров и при необходимости их полную утилизацию и захоронение отходов. Это необходимо учитывать на ранних стадиях проектирования продукта, чтобы обеспечить эффективную поддержку жизненного цикла. При таком подходе уже при разработке продуктов предусматриваются конкретные способы их возврата от потребителей, переделки для повторного использования или полной переработки.
Двигательная функция белков заключается в следующем: некоторые белки принимают непосредственное участие в движении клеток и перемещении клеточных структур или входят в состав структурных компонентов, участвующих в движении. В процессе выполнения свой функции двигательные белки изменяют свой размер или пространственное расположение своих частей относительно друг друга или других белков. Приведем несколько примеров двигательных белков:
 а) Актин - самый распространенный белок эукариотических клеток: на его долю приходится около 5% общего белка. Молекула актина представляет собой полипептид, состоящий из 375 аминокислотных остатков. Актин входит в состав микрофиламентов. Микрофиламент – нитевидная структура цитоплазмы клетки, состоящая из глобулярных молекул актина. Соединяясь друг с другом, молекулы актина образуют плотную спираль. Актиновые микрофиламенты собираются спонтанно из глобулярного актина на обоих концах микрофиламента. Быстро растущий конец называется плюс-концом, а медленно растущий – минус-концом (рис.1-52).
а) Актин - самый распространенный белок эукариотических клеток: на его долю приходится около 5% общего белка. Молекула актина представляет собой полипептид, состоящий из 375 аминокислотных остатков. Актин входит в состав микрофиламентов. Микрофиламент – нитевидная структура цитоплазмы клетки, состоящая из глобулярных молекул актина. Соединяясь друг с другом, молекулы актина образуют плотную спираль. Актиновые микрофиламенты собираются спонтанно из глобулярного актина на обоих концах микрофиламента. Быстро растущий конец называется плюс-концом, а медленно растущий – минус-концом (рис.1-52).

|
Микрофиламенты являются очень динамичными структурами, которые изменяют свою длину, обеспечивая движение клеток или их частей. С микрофиламентами связано образование различных подвижных выростов движущейся или растущей клетки Непрерывный рост микрофиламентов под наружной плазматической мембраной способствует вытягиванию переднего края клетки и помогает тем самым ее движению вперед. Микрофиламенты входят также в состав микроворсинок клеток, миофибрилл мышечных волокон и сократимого кольца делящейся клетки, которое обеспечивает деление цитоплазмы животной клетки при митозе и мейозе.
б) Миозин присутствует почти во всех клетках позвоночных и всегда находится в сократительных пучках, образуемых актиновыми микрофиламентами. В мышечных и немышечных клетках имеются разные формы миозина. Молекула мышечного миозина состоит из шести полипептидных цепей – двух одинаковых тяжелых цепей и двух пар легких цепей (рис.1-53). Каждая тяжелая цепь состоит из приблизительно 2000 аминокислотных остатков и в большей своей части скручивается в α-спираль; две такие параллельно расположенные α-спирали обвиваются друг около друга, образуя ‘’скрученную спираль’’. Этот нитевидный участок мышечного миозина называется миозиновым хвостом. На N-конце тяжелой цепи миозина находится ее глобулярный участок, с которым связаны две легкие цепи, одна из которых содержит около 170, а другая – около 190 аминокислотных остатков. Совокупность глобулярного участка тяжелой цепи и легких цепей двух типов называется миозиновой головкой. Именно она расщепляет АТФ и взаимодействует с актиновым микрофиламентом.

 4
4


 С-конец 1
С-конец 1
 |  | ||||
 | |||||



 3
3


 С-конец
С-конец
 2
2
Рис.1-53. Упрощенная схема строения молекулы мышечного миозина.
1 – длинные фрагменты двух тяжелых цепей, сворачивающиеся в α-спирали, которые, обвиваясь друг около друга, образуют ‘’скрученную спираль’’ – миозиновый хвост
2 - глобулярные фрагменты тяжелых цепей
3 – легкая цепь, состоящая из приблизительно 170 аминокислотных остатков
4 - легкая цепь, состоящая из приблизительно 190 аминокислотных остатков
2+3+4 – миозиновая головка
1 и 2 – два участка тяжелой цепи
Актин и миозин входят в состав многочисленных миофибрилл - нитевидных структур сократительного аппарата цитоплазмы мышечных волокон скелетных и сердечной мышц. Каждая миофибрилла образована повторяющимися единицами – саркомерами. Каждый саркомер состоит из многочисленных тонких и толстых филаментов. Толстый филамент представляет собой пучок из сотен молекул миозина, а основу тонкого филамента составляет актиновый микрофиламент. Миозиновые и актиновые филаменты расположены параллельно друг другу строго определенным образом: в каждом участке миофибриллы вокруг толстого миозинового филамента расположено шесть тонких актиновых филаментов (рис.1-54). При сокращении тонкие и толстые филаменты взаимодействуют друг с другом, что сопровождается перемещением их относительно друг друга и, в конечном итоге, укорочением саркомера.

|
В тонком филаменте актиновый микрофиламент связан с белками, одни из которых препятствуют его взаимодействию с миозином, а другие после связывания ионов кальция снимают это препятствие. Ионы Са2+ при возбуждении мышечного волокна выходят из полостей гладкой эндоплазматической сети (ЭПС) и запускают сокращение. В толстом филаменте спиральные участки тяжелых цепей сотен молекул миозина упакованы в пучок, где они удерживаются вместе ионными связями; миозиновые головки торчат из этого пучка (рис.1-55). В каждом толстом филаменте содержится приблизительно 500 миозиновых головок. Специальные белки связывают тонкие филаменты с тонкими, а толстые – с толстыми, обеспечивая строго упорядоченное расположение их в миофибрилле.


 1 2
1 2
 |
Рис.1-55. Схема строения толстого миозинового протофиламента.
1 – головки молекул миозина
2 – нитевидные участки молекул миозина
Для сокращения миофибрилл необходимы молекулы АТФ в качестве источника энергии и ионы кальция, которые взаимодействуют с белками тонкого филамента, препятствующими взаимодействию актина с миозином, и снимают их ингибирующее влияние. При возбуждении мышечного волокна ионы Са2+ очень быстро выходят из полостей гладкой эндоплазматической сети, где они находятся в большой концентрации. В присутствии АТФ и ионов Са2+ каждая миозиновая головка расщепляет АТФ, прочно связывается с актиновым филаментом и претерпевает конформационное изменение, совершая при этом силовой акт и подтягивая толстый филамент к тонкому филаменту. Миозиновые головки ‘’шагают’’ по актиновым филаментам в сторону их плюс-концов. Повышение концентрации ионов кальция около миофибрилл кратковременно, так как эти ионы очень быстро перекачиваются обратно в полости ЭПС. В отсутствии ионов Са2+ взаимодействие актиновых и миозиновых филаментов прекращается; эти филаменты возвращаются в исходное состояние – происходит расслабление мышечного волокна.
в) Белок тубулин присутствует во всех клетках эукариот. Из него образованы микротрубочки – полые трубчатые структуры (рис.1-56). Молекула тубулина состоит из двух прочно связанных глобулярных полипептидов, которые близки по химическому составу и содержат приблизительно по 450 аминокислотных остатков каждый. Микротрубочки являются постоянно изменяющимися структурами. В микротрубочке различают плюс- и минус-концы: молекулы тубулина быстро добавляются к растущему плюс-концу и отщепляются от медленно растущего минус-конца. В клетке существуют механизмы, стабилизирующие размер микротрубочек.

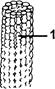
|
Из микротрубочек построены нити веретена деления, которое формируется в делящейся клетке. При митозе и мейозе микротрубочки прикрепляются к хромосомам и с помощью двигательных белков перемещают их сначала в область экватора веретена деления, а затем - к его полюсам.
Из микротрубочек образованы жгутики и реснички эукариотических клеток. Жгутики и реснички представляют собой очень длинные выросты клетки, под плазматической мембраной которых расположен целый комплекс из десяти пар микротрубочек: две микротрубочки расположены в центре, а вокруг них по окружности расположены остальные девять пар микротрубочек (рис.1-57).
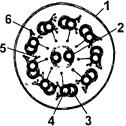
|
С одной из микротрубочек каждой пары прочно связаны молекулы двигательного белка динеина. Используя энергию АТФ, молекулы динеина перемещаются по микротрубочке соседней пары, что сопровождается изгибанием пар микротрубочек, закрепленных у своего основания (рис.1-58). Согласованное и упорядоченное взаимодействие микротрубочек ведет к созданию вращательного, хлыстообразного или волнообразного движения жгутика и реснички.
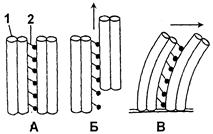
|

г) Белок флагеллин входит в состав жгутиков бактерий;
д) Белки динеин и кинезин являются молекулярными двигателями, которые осуществляют перемещение клеточных органелл – митохондрий, секреторных пузырьков - вдоль микротрубочек (рис.1-59). По своему строению они похожи на миозин. Своими глобулярными участками эти белки связаны с микротрубочкой, а своей хвостовой частью – с перемещаемой органеллой. Используя энергию АТФ, динеин и кинезин перемещают связанные с ними структуры в нужном направлении. Динеин всегда двигается к минус-концу микротрубочки, а кинезин – к ее плюс-концу.

 4
4
 1
1







 3
3



 |



 +
+
 | |||
 | |||

 5
5
Рис.1-59. Динеин и кинезин – двигательные белки микротрубочек.
1 – динеин
2 – кинезин
3 – микротрубочка
4 – органелла,перемещаемая динеином в сторону минус-конца микротрубочки
5 - органелла,перемещаемая кинезином в сторону плюс-конца микротрубочки
"+" – быстро растущий плюс -конец микротрубочки
"-" – медленно растущий минус -конец микротрубочки
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5789; Нарушение авторских прав?; Мы поможем в написании вашей работы!