
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зонная теория электропроводности
|
|
|
|
По своим электронным свойствам твёрдые тела разделяются на металлы, диэлектрики и полупроводники. Кроме того, при низких температурах возможно сверхпроводящее состояние, в котором сопротивление электрическому току равно нулю.
 Рис. 5 Металл Рис. 5 Металл
                   e e
|
Движение микрочастиц подчиняется законам квантовой механики. У связанных электронов, например в атоме, энергия может принимать только определённые к в а н т о в а н н ы е з н а ч е н и я. В твёрдом теле эти уровни энергии объединяются в зоны, разделённые запрещёнными областями энергии (рис. 5). В силу принципа Паули электроны не скапливаются на нижнем уровне, а занимают уровни с разными энергиями. В результате может оказаться, что все уровни энергии в зоне будут полностью заполнены. Такое твёрдое тело является диэлектриком. Такое твёрдое тело является диэлектриком. Изменить энергию электрона можно только сразу на большую конечную величину (ширину запрещённой области, или, как говорят, энергетической щели). Поэтому электроны в диэлектрике не могут ускоряться в электрическом поле, и проводимость при нулевой температуре (когда нет тепловых возбуждений) равна нулю (сопротивление бесконечно).
В металле, напротив, верхний заполненный уровень энергии лежит внутри зоны, энергия электронов может меняться почти непрерывно, и электрическое поле создаёт ток. Упорядоченное движение электронов вдоль поля накладывается на интенсивное хаотическое движение. Максимальная энергия электронов определяется их концентрацией. В типичных металлах это величина порядка электрон-вольт. Соответствующая такой энергии температура» 104К! Так что даже при абсолютном нуле часть электронов в металле энергично движется и имеет огромную эффективную температуру.
| Рис. 6 зона проводимости запретная зона зона валентности возбуждение электронов в полупроводнике |
Полупроводник - это тот же диэлектрик, но с малой величиной энергетической щели. Тепловое движение может “забрасывать” электроны в свободную зону (она называется зоной проводимости в отличие от заполненной валентной зоны), где они уже ускоряются электрическим полем (рис. 6). Поэтому полупроводники обычно имеют небольшую проводимость, резко зависящую от температуры. На проводимость полупроводников можно также влиять, вводя специальные примеси.
Полупроводниковые кристаллы позволяют создавать сложные полупроводниковые приборы, в том числе так называемые интегральные схемы. Сейчас достигнута такая степень интеграции, что миллионы отдельных элементов умещаются на площади размером в 1 см2! Такое устройство как бы является единым кристаллом, и новую область техники не зря называют твердотельной электроникой.
Огромное значение для современной техники имеют магнитные материалы. Атомы (или часть атомов), из которых состоит магнитное тело, могут обладать магнитным моментом. Если взаимодействие между магнитными моментами велико, то они выстраиваются определенным образом и твёрдое тело переходит в ферромагнитное или антиферромагнитное состояние.
КЛАССИФИКАЦИЯ ЭТМ ПО ЭЛЕКТРОПРОВОДНОСТИ
Величина запрещенной зоны определяет класс вещества:
Так, диэлектрики имеют Ез=4…6 эВ. Такая величина Ез практически полностью исключает электронную проводимость диэлектриков в слабых электрических полях. Удельное объемное электросопротивление диэлектриков r более 107 Ом.м.
Полупроводники обладают более узкой запрещенной зоной: 0.1…4 эВ. Такой энергетический барьер может быть преодолен за счет внешних энергетических воздействий (электрического поля, электромагнитного излучения). r = 0,1…107 Ом.м
Проводники отличаются отсутствием запрещенной зоны. Электроны в проводниках свободно переходят с заполненных уровней валентной зоны на незанятые уровни зоны проводимости за счет приложенного к проводнику слабого электрического поля. Их удельное сопротивление r <0,1 Ом.см
ВИДЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Объединение атомов в молекулы вещества, находящегося в газообразном, жидком или твердом состоянии, а также объединение атомов или ионов в твердое тело с атомным, металлическим или ионным строением происходит под действием химической связи. Объединение молекул в вещества, находящиеся в газообразном, жидком или твердом состоянии, осуществляется под действием межмолекулярных связей, часто называемых силами Ван-дер-Ваальса. Природа химической и межмолекулярной связей единая — электрическая. Различают несколько типов химической связи, наиболее важными из которых являются ковалентная и ионная.
Ковалентная связь осуществляется за счет образования общей одной пары (или нескольких пар) электронов, которые ранее принадлежали отдельным атомам. При образовании общей одной пары электронов от каждого объединяемого атома вносится по одному валентному электрону. Например, у молекулы хлора одна пара валентных электронов образует ковалентную связь, у молекулы азота — три пары:
:n-+'n:=:n::n:
Общие пары электронов
Следовательно, ковалентная связь может быть одинарной, например у С12, и кратной (двойной, тройной), например у N2.
Электроны при движении по орбитам чаще находятся между ядрами, где создается как бы избыток отрицательного заряда, что способствует сближению атомов (рис.).
Если молекула состоит из атомов одного и того же химического элемента (C12,N2,H2 и т.п), то электронная пара (одна или несколько) в одинаковой степени принадлежит этим атомам. В этом случае ковалентная связь является неполярной или нейтральной, и образуемые молекулы тоже являются неполярными. В неполярных молекулах центры положительных и отрицательных зарядов совпадают (/ = 0) и, следовательно, электрический дипольный момент ц равен нулю (см. ()). Диэлектрический материал, образованный неполярными молекулами, является неполярным. Рассмотренное выше схематичное строение молекул С12, N2, H2 — пример неполярных веществ, в образовании которых участвовала неполярная ковалентная связь.
Если молекула состоит из атомов различных химических элементов, то электронная пара будет смещена в сторону атома с большей электроотрицательностью (ЭО). Мерой ЭО может служить арифметическая сумма энергии ионизации Wи и сродства к электрону Wc:
ЭО = Wи+ Wcр, ()
Wcр, и Wи необходимо брать в одинаковых единицах измерения.
Введем некоторые понятия - энергетические характеристики атомов, необходимые для понимания природы химических связей.
Потенциал (энергия) ионизации Wи — это то количество энергии, которое нужно затратить, чтобы перевести нейтральный атом (молекулу) в положительно заряженный ион. Первичный потенциал ионизации j1 – энергия, необходимая для отрыва первого валентного электрона от атома (j2 – второго и т.д.).
В каждом периоде таблицы Д. И. Менделеева наименьшее значение Wu имеют химические элементы, начинающие период, т.е. щелочные металлы. Например, для U Wи = 5,37 эВ, Na = 5,09 эВ и К = 4,32 эВ. Наибольшее значение Wи имеют химические элементы, заканчивающие период, т.е. инертные газы. Например, для Не = 24,5838, Ne = 21,56эВ, Аl = 15,76 эВ. Таким образом, чем больше электронов во внешней оболочке атома, как правило, прочнее их связь с ядром и тем более затруднено превращение атома в положительный ион. Ионизация атомов (молекул) предпочтительно является однократной, а не многократной, так как энергия ионизации с каждым последующим теряемым электроном возрастает, особенно значительно при переходе на последующий электронный уровень. Например, для аргона Аг энергия ионизации Wи 1-го электрона составляет 15,76 эВ, 2-го = 27,62 эВ, 3-го = 40,9 эВ, 4-го =59,79 эВ, 5-го = 75,0 эВ, 6-го = 91,3 эВ, 7-го = 124,0 эВ, 8-го = 143,46 эВ, а Wи для 1-го электрона из второго электронного уровня равна 421 эВ, т.е. почти в три раза больше, чем для восьмого электрона — последнего из третьего уровня.
Сродство к электрону Wcр — это то количество энергии, которое выделяется при присоединении электрона к нейтральному атому (молекуле) или (-) иону, т.е. это энергия превращения нейтрального атома в отрицательно заряженный ион. Чем больше Wcр, химического элемента, тем сильнее выражены его свойства как неметалла (сравните, например: для атома кислорода Wcр, = 2,3 эВ, а атома водорода = 0,74 эВ). Самые высокие значения Wcр, имеют галогены: для F Wcр, = 3,6 эВ, С1 = 3,8 эВ, Вг = 3,5 эВ, I=3,2 Эв..
Энергия связи электрона – энергия для отрыва данного (любого) электрона от атома.
Электроотрицательность атома (каппа)
 [эВ]
[эВ]
Каппа является критерием образования того или иного вида связи в диэлектриках. При химическом взаимодействии атом с большей k отбирает электрон у атома с меньшей k
Рассмотрим 3 случая:
1)  >>
>> 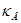 – образуется ионная связь (гетерополярная)
– образуется ионная связь (гетерополярная)
например – хлорид натрия – хлор забирает 1 вал. электрон у натрия, образуется полярная молекула.
Таким образом, ионная связь определяется силами притяжения между (+)
и (-) ионами. Типичные ионные диэлектрики – стекла, керамика, фарфоры, ЩГК.
2)  ~
~ 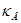 – образуется ковалентная (гомеополярная) связь. Данный тип связи образуется электронными парами за счет их объединения (обобществления). Например – водород Н2
– образуется ковалентная (гомеополярная) связь. Данный тип связи образуется электронными парами за счет их объединения (обобществления). Например – водород Н2
Ковалентная связь отличается тем, что центр тяжести (+) и (-) зарядов – в одной точке, т.е. образуется электрически нейтральная молекула.
Ковалентной гомеополярной связью обладают неполярные диэлектрики.
3)  и
и 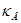 незначительно отличаются – также образуется ковалентная связь, но она уже называется полярной, т.к. центр тяжести (-) заряда смещен в сторону более электроотрицательного атома. Т.е. образуется полярная молекула
незначительно отличаются – также образуется ковалентная связь, но она уже называется полярной, т.к. центр тяжести (-) заряда смещен в сторону более электроотрицательного атома. Т.е. образуется полярная молекула
У химических элементов, расположенных в одном периоде таблицы Д.И. Менделеева, ЭО возрастает слева направо, а у элементов, расположенных в одной группе, ЭО сильнее выражена у стоящих выше (табл.).
Таблица
Электроотрицательность (в единицах шкалы Полинга) химических элементов
| 7, | Элемент | ЭО | Z | Элемент | ЭО | Z | Элемент | ЭО | Z | Элемент | ЭО |
| Н | 2,1 | Co | 1,70 | I | 2,21 | Au | 1,42 | ||||
| Не | — | Ni | 1,75 | Xe | - | Hg | 1,44 | ||||
| Li | 0,97 | Cu | 1,75 | Cs | 0,86 | Tl | 1,44 | ||||
| Be | 1,47 | Zn | 1,66 | Ba | 0,97 | Pb | 1,55 | ||||
| В | 2,01 | Ga | 1,82 | La | 1,08 | Bi | 1,67 | ||||
| С | 2,50 | Ge | 2,02 | Ce | 1,08 | Po | 1,76 | ||||
| N | 3,07 | As | 2,20 | Pr | 1,07 | At | 1,90 | ||||
| 3,50 | Se | 2,48 | Nd | 1,07 | Rn | — | |||||
| F | 4,10 | Br | 2,74 | Pm | 1,07 | Fr | 0,86 | ||||
| Ne | — | Kr | — | Sm | 1,07 | Ra | 0,97 | ||||
| Na | 1,01 | Rb | 0,89 | Eu | 1,01 | Ac | 1,00 | ||||
| Mg | 1,23 | Сr | 0,99 | Gd | 1,11 | Th | 1,11 | ||||
| Al | 1,47 | Y | 1,11 | Tb | 1,10 | Pa | 1,14 | ||||
| Si | 1,74 | Zr | 1,22 | Dy | 1,10 | U | 1,22 | ||||
| P | 2,06 | Nb | 1,23 | Ho | 1,10 | Np | 1,22 | ||||
| S | 2,44 | Mo | 1,30 | Er | 1,10 | Pu | 1,22 | ||||
| Cl | 2,83 | Tc | 1,36 | Tm | 1,10 | Am | (1,2) |
| z | Элемент | ЭО | Z Элемент ЭО | Z Элемент ЭО | Z Элемент ЭО | ||||||
| Аг | — | 44 Ru 1,42 | 70 Yb 1,06 | 96 Cm (1,2) | |||||||
| К | 0,91 | Rh | 1,45 | Lu | 1,14 | Bk | (1,2) | ||||
| Са | 1,04 | Pd | 1,35 | Hf | 1,23 | Cf | (1,2) | ||||
| Sc | 1,20 | Ag | 1,42 | Та | 1,33 | Es | (1,2) | ||||
| Ti | 1,32 | Cd | 1,46 | W | 1,40 | Fm | (1,2) | ||||
| V | 1,45 | In | 1,49 | Re | 1,46 | Md | (1,2) | ||||
| 24 | Сг | 1,55 | Sn | 1,72 | Os | 1,52 | (No) | (1,2) | |||
| Мп | 1,60 | Sb | 1,82 | Ir | 1,55 | ||||||
| Fe 1,64 | Те | 2,01 | Pt | 1,44 |
В результате смещения электронной пары в сторону атома с большей ЭО произойдет поляризация молекулы. При этом центры положительных и отрицательных зарядов сместятся на некоторое расстояние друг от друга, ковалентная связь станет полярной. Полярной или дипольной станет сама молекула.
Еще один вид связи – металлическая связь – обусловлена притяжением между (+) ионами и свободными электронами. В ковалентной связи обобществляются валентные электроны двух соседних атомов, в металлической – все валентные электроны являются свободными, «общими». Т.е., валентные электроны в ковалентных твердых телах коллективизированы соседними атомами и локализованы вдоль линий, соединяющих эти атомы. В металлах коллективизация электронов достигает максимума – все валентные электроны коллективизируются всеми ионными остовами. Идеальный металл можно рассматривать как состоящий из периодически расположенных ионных остовов, которые погружены в газ электронов проводимости, свободно движущихся между ионными остовами. Эти электроны компенсируют силы электрического отталкивания между положительными ионами и тем самым связывают их в твердые тела. Стабильность металла и величина его энергии связи определяются кулоновскими силами притяжения между положительными ионными остовами и отрицательно заряженным электронным газом. Подвижные электроны проводимости ответственны за высокую электро- и теплопроводность металлов.
Металлическая связь обусловила важнейшие физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск.
Высокая электропроводность металлов объясняется присутствием свободных электронов, которые под влиянием даже небольшой разности потенциалов перемещаются от отрицательного полюса к положительному С повышением температуры колебания ионов и атомов металлов усиливаются, что затрудняет движение электронов и тем самым приводит к уменьшению электропроводности. При низких же температурах колебательное движение ионов и атомов, наоборот, сильно уменьшается, и электропроводность возрастает. Вблизи абсолютного нуля электрическое сопротивление у металлов практически отсутствует. Лучший проводник электричества - серебро, за ним идут медь, золото, алюминий, железо. Также изменяется и теплопроводность металлов, которая вызвана как высокой подвижностью свободных электронов, так и колебательным движением ионов, благодаря чему происходит быстрое выравнивание температуры в массе металла. Металлический блеск тоже связан с наличием свободных электронов.
Такая модель металла со свободными электронами лучше всего подходит для щелочных металлов и менее пригодна для благородных металлов – меди, серебра и золота. В щелочных металлах ионные остовы занимают лишь малую долю полного объема (около 15%), тогда как в серебре и золоте соседние ионные остовы чуть ли не соприкасаются друг с другом.
И последний вид связи – самая слабая-молекулярная связь (связь Ван-дер-Ваальса) – существует между молекулами в некоторых веществах с ковалентной внутримолекулярной связью. Притяжение между молекулами здесь обеспечивается согласованным движением электронов в соседних молекулах: в любой момент времени электроны максимально удалены друг от друга и максимально приближены к (+) ионам. При этом сила притяжения электронов с (+) ионами выше, чем сила отталкивания между электронами внешних орбит.
Контрольные вопросы
1. Назовите классы структур твердых тел
2. Раскройте основные положения зонной теории электропроводности
3. Приведите классификацию ЭТМ по электропроводности.
4. Приведите виды и понятия химических связей. Потенциал ионизации. Сродство к электрону. Электроотрицательность атома.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1465; Нарушение авторских прав?; Мы поможем в написании вашей работы!