
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия активации, уравнение Аррениуса
|
|
|
|
Известно, что одним из необходимых условий химических превращений является столкновение молекул. Однако одного этого условия недостаточно, т.к. только при повышении температуры скорость процесса
возрастает.
Аррениус высказал мысль, что реакционноспособными являются не все, а только активные молекулы N*. Согласно теории Аррениуса соударения будут эффективными только тогда, когда встречающиеся молекулы обладают некоторым избытком энергии по сравнению со средней энергией молекул в системе при данной температуре. Молекулы, несущие в себе эту избыточную энергию называются активными, а сам избыток энергии – энергией активации.
Аррениус (1889) предложил эмпирическое уравнение, связывающее константу скорости с температурой
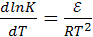 (16.4)
(16.4)
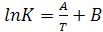 (16.5)
(16.5)
где 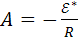 .
.
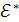 – энергия активации, кал/моль;
– энергия активации, кал/моль;
R – универсальная газовая постоянная, кал/моль·К
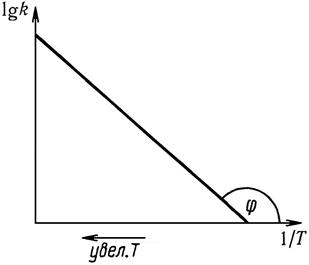
Рис. 16.2 График зависимости lgk=f (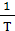 )
)
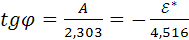 (16.6)
(16.6)
Следовательно, тангенс угла наклона зависимость lgk=f (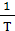 ) определяет величину энергии активации химической реакции.
) определяет величину энергии активации химической реакции.
Таким образом, анализируя экспериментальную зависимость lgk от 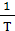 можно определить
можно определить 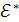 . Однако для сложных реакций не получается линейной зависимости и уравнение Аррениуса не выполняется. В этих случаях эффективная энергия активации изменяется с температурой и ее находят, используя уравнение
. Однако для сложных реакций не получается линейной зависимости и уравнение Аррениуса не выполняется. В этих случаях эффективная энергия активации изменяется с температурой и ее находят, используя уравнение

по наклону касательной к кривой зависимости lgk=f (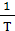 ) в нужной точке.
) в нужной точке.
По физическому смыслу 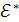 – можно определить как некоторую избыточную энергию по сравнению со средней энергией молекул при данной температуре, которой они должны обладать, чтобы их столкновение привело к химической реакции (
– можно определить как некоторую избыточную энергию по сравнению со средней энергией молекул при данной температуре, которой они должны обладать, чтобы их столкновение привело к химической реакции (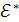 ≈ 10−100 ккал/моль (50−250 кДж/моль)). Таким образом,
≈ 10−100 ккал/моль (50−250 кДж/моль)). Таким образом, 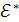 – это энергетический и активационный барьер реакции, определяемый природой реагирующих веществ и катализатора.
– это энергетический и активационный барьер реакции, определяемый природой реагирующих веществ и катализатора.
Если бы каждое соударение приводило к химическому взаимодействию, то реакции проходили бы мгновенно. Следовательно, на практике не все соударения эффективны. Реагируют только молекулы, обладающие повышенной энергией. Для каждой реакции характерна определённая величина энергии активации, которая рассчитывается на моль реагирующего вещества.
Итак, скорость химической реакции обусловлена не общим числом столкновений молекул, а числом столкновений активных молекул. Соотношение между активными и неактивными молекулами определяется законом распределения Максвелла–Больцмана:
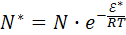 (16.7)
(16.7)
где е – основание натурального логарифма, равное 2,71.
Однако не каждое столкновение активных молекул приводит к химической реакции, так как для ее протекания необходима определенная пространственная ориентация молекул.
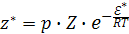 (16.8)
(16.8)
где z* – число активных столкновений;
Z –общее число столкновений молекул;
p – стерический фактор.
Сблизившиеся молекулы взаимодействуют не моментально, перераспределение энергии требует определенного времени и молекулы могут разойтись не прореагировав.
Энергетические изменения в системе реагирующих веществ можно изобразить схемой:
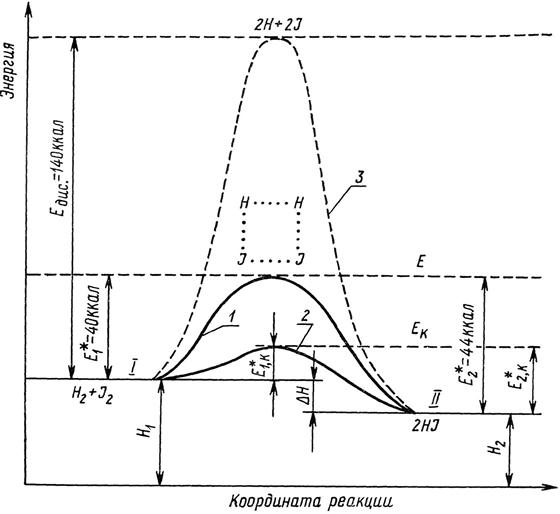
Рис. 16.3 Изменение энергии в ходе реакции Н2+I2↔2НI. Кривые процесса:
1 – некаталитического;
2 – каталитического;
3 – диссоциации молекул на атомы.
Химическую реакцию можно представить как переход системы из энергетического состояния I в энергетическом состоянии II, сопровождающийся тепловым эффектом ΔН. Установлено, что реакция протекает через переходное состояние с образование активного комплекса.
Например, для реакции Н2+I2↔2НI активным комплексом является молекула Н2I2. В активном комплексе «полуразорвавшиеся» старые связи (Н…Н и I…I) «полуобразовавшиеся» новые (Н…I). Образованные активные комплексы энергетически более выгодно, чем полный распад исходных молекул на атомы 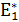 ˂Едис (рис. 16.3). Как следует из графика, тепловые эффекты прямой ΔН1 и обратной ΔН2 реакции можно выразить не только через Н1 и Н2, но через Е*:
˂Едис (рис. 16.3). Как следует из графика, тепловые эффекты прямой ΔН1 и обратной ΔН2 реакции можно выразить не только через Н1 и Н2, но через Е*:
ΔН1=(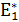 −
−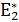 ) < 0, ΔН2=(
) < 0, ΔН2=(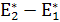 ) > 0 (16.9)
) > 0 (16.9)
При сопоставлении двух однотипных реакций А и В, исходя из термодинамических законов, можно утверждать, что реакция А более предпочтительная, если ΔGА ˂ ΔGB. Но если 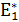 >
> 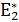 , то порядок их протекания будет обратным.
, то порядок их протекания будет обратным.
Высокое значение 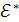 для любой химической реакции является нежелательным, так как на пути к её осуществлению стоит высокий энергетический барьер. Преодолеть этот барьер может только небольшая доля от общего числа молекул и если с помощью специальных мер не повысить эту долю активных молекул N*, скорость реакции будет небольшой.
для любой химической реакции является нежелательным, так как на пути к её осуществлению стоит высокий энергетический барьер. Преодолеть этот барьер может только небольшая доля от общего числа молекул и если с помощью специальных мер не повысить эту долю активных молекул N*, скорость реакции будет небольшой.
Установлено, что в ходе химического процесса разрыв химических связей в молекулах исходных веществ и образование новых химических связей в продуктах реакции необходимо рассматривать не обособленно, а в их взаимном влиянии. Обычно первой ступенью практически любой химической реакции является образование непрочного промежуточного соединения АК (активированного комплекса). АК не является химическим соединением в подлинном смысле слова. В нем еще не исчезли первоначально существующие в молекулах исходных веществ связи между атомами и не вполне оформились новые химические связи. Однако электронные оболочки атомов в молекулах исходных веществ уже определенным образом деформированы и прежние связи ослаблены.
Образование такого активированного комплекса требует меньших затрат энергии, чем разрыв связей в молекулах исходных веществ, так как теперь этому разрыву содействует наметившиеся наведения новых связей. При этом и энергетический эффект образования молекул конечного продукта путем распада активированного комплекса будет тоже меньше. Таким образом, образование непрочного АК приводит к уменьшению высоты энергетического активационного барьера.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3321; Нарушение авторских прав?; Мы поможем в написании вашей работы!