
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы для самопроверки. 1. На какие группы делятся растворенные в жидкостях вещества по их влиянию на величину поверхностного натяжения?
|
|
|
|
1. На какие группы делятся растворенные в жидкостях вещества по их влиянию на величину поверхностного натяжения? Охарактеризуйте эти вещества.
2. Что такое дифильные молекулы? Приведите примеры химических соединений с дифильными молекулами.
3. Напишите уравнение Гиббса, постройте изотерму адсорбции, поясните ее.
4. Как рассчитать площадь, приходящуюся на одну молекулу ПАВ в насыщенном поверхностном слое и толщину адсорбционного слоя?
5. Сформулируйте правило Траубе-Дюкло, поясните при каких условиях оно справедливо.
6. Рассмотрите уравнения Шишковского, объясните смысл эмпирических констант в уравнении Шишковского
7. Каким образом используется уравнение Шишковского для проверки возможности применения правила Траубе-Дюкло к отдельным классам органических соединений?
Лекция 19. Адсорбция из растворов на твёрдых поверхностях
19.1 Адсорбция на твёрдых поверхностях, физическая и химическая адсорбция, их особенности
19.2 Теория молекулярной адсорбции, уравнение Ленгмюра, анализ, применение
19.3 Уравнение Фрейндлиха, графическое определение констант адсорбции
19.1 Адсорбция на твёрдых поверхностях, физическая и химическая адсорбция, их особенности.
Адсорбция на твердой поверхности во многом аналогична адсорбции на поверхности жидкости. Однако есть и своя специфика.При адсорбции на поверхности жидкости адсорбированное вещество обычно извлекается из самой жидкой фазы. Адсорбция компонента на твёрдой поверхности чаще происходит из внешней среды – жидкой или газообразной. При этом ПАВ понижает поверхностное натяжение твёрдого тела.
Согласно современным представлениям на твердой поверхности адсорбента находятся активные центры (различные микровыступы, впадины, трещины, рёбра, углы кристаллов, др. дефекты). О наличии активных центров свидетельствуют факты уменьшения теплоты адсорбции, отравления катализаторов, другие факты.
Адсорбция газа на твердой поверхности является простейшим случаем адсорбционного процесса, так как система состоит всего из двух компонентов. Опыт показывает, что при прочих равных условиях для твердого адсорбента и адсорбируемого газа количество адсорбируемого вещества будет возрастать по мере увеличения адсорбирующей поверхности. Следовательно, чтобы достигнуть большего адсорбционного эффекта, необходимо иметь как можно большую поверхность поглотителя. Способность адсорбента к поглощению газов определяется не только его пористостью, но физическим состоянием; например, адсорбенты в аморфной форме лучше адсорбируют газы, чем в кристаллической.
Как показали исследования, время пребывания молекул газа на поверхности твердого адсорбента очень мало: они удерживаются на адсорбенте всего сотые и тысячные доли секунды и, десорбируясь, замещаются на новые частицы. В конечном итоге устанавливается динамическое равновесие между свободными и десорбированными молекулами. Скорость достижения сорбционного равновесия для разных газов неодинакова: при адсорбции СО2 на угле равновесие наступает через 20 сек, при адсорбции О2 – через 2,5 часа, при адсорбции N2 – через 20 часов и т.д. Скорость адсорбции имеет важное значение для практического использования различных адсорбентов.
Для объяснения явлений адсорбции существуют различные теории. Различают физическую и химическую адсорбцию веществ на твердой поверхности:
1) Физическая адсорбция обусловлена межмолекулярными силами Ван-дер-Ваальса между молекулами адсорбента и адсорбтива, причем природа адсорбционных сил чисто физическая. Она обратима (процессы адсорбции и десорбции), малоспецифична. Например, адсорбция на угле из газообразной фазы – Br2, CI2, NH3, CO2 и др. Физическая адсорбция – экзотермический процесс, для нее характерны низкие теплоты адсорбции, ΔНа. Адсорбция велика при любой температуре, так как она мало зависит от температуры и определяется в основном скоростью диффузии молекул адсорбтива к поверхности твердого адсорбента.
2) Химическая адсорбция (хемосорбция), при которой адсорбционные силы имеют химическую (валентную) природу. Для хемосорбции теплота адсорбции значительно выше, величина ΔНа имеет порядок теплот химических реакций (ΔНа ≈ − 200 ккал/моль). При хемосорбции адсорбтив прочно связан с адсорбентом. Предполагают, что она сопровождается образованием новых поверхностных химических соединений, причем хемосорбция необратима. При повышении температуры скорость хемосорбции резко возрастает, как в случае обычной химической реакции.
Экспериментально установлено, что на одном и том же адсорбенте при равных условиях лучше адсорбируются газы, которые легче сжижаются, т.е. температура кипения которых выше. Установлено, что на активированном угле из смеси воздух + CI2 преимущественно адсорбируется последний. На различии в адсорбционной способности газов основан принцип работы противогаза (Зелинский). Например, в широко используемом противогазе при химической защите, проходящей через коробку воздух, должен очень быстро очищаться от примесей отравляющих веществ. Это возможно лишь при высоких скоростях адсорбционных процессов.
Активированный уголь в противогазе играет роль не только адсорбента целого ряда отравляющих веществ, но и катализатора реакции разложения многих из них. В качестве примера можно указать на каталитический гидролиз фосгена
СОСI2 + Н2О → 2НСI + СО2
или хлорпикрина
ССI3NO2 + 2H2O → СО2 + 3 НСI + HNO2
Как указывалось выше, характер адсорбции зависит не только от природы поглотителя, но и от природы поглощаемого газа.
О величине адсорбции в системе твердое вещество – жидкость часто судят по количеству адсорбтива, приходящегося на единицу массы адсорбента (так как поверхность твёрдых адсорбентов не всегда известна). Величина адсорбции зависит от С, р, Т, от природы адсорбента и адсорбтива и рассчитывается по формуле:
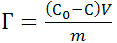 (моль/л); (19.1)
(моль/л); (19.1)
где С0 и С – начальная и равновесная концентрации адсорбтива,
V – объём раствора, из которого происходит адсорбция,
m – масса адсорбента, г.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 334; Нарушение авторских прав?; Мы поможем в написании вашей работы!