
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Учет притяжения между молекулами
|
|
|
|
Силы притяжения молекул газа друг к другу как бы помогают силам внешнего давления сжимать газ. Следовательно, в формуле Клапейрона-Менделеева вместо внешнего давления на газ р необходимо ввести сумму внешнего и молекулярного давлений (р + р’), где р’ – молекулярное давление. По вычислениям Ван-дер-Ваальса, молекулярное давление обратно пропорционально квадрату объема газа, т.е. р’ =а/V2, где а- некоторый коэффициент пропорциональности, зависящий от природы газа. Введя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
(р + а/Vm2) (Vm -b) = RT (3. 5)
Для произвольного количества вещества n= m/m с учетом того, что V = nVm, уравнение Ван-дер-Ваальса принимает вид:
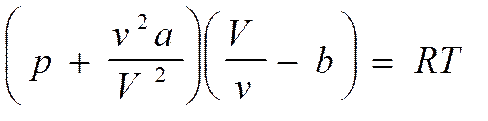
Уравнение Ван-дер-Ваальса дает гораздо  лучшее согласие с опытом, чем уравнение Клапейрона-менделеева. Так, для 1 моля азота при 00С и давлении 1000 атм произведение pV= RT вырастает в два с лишним раза по сравнению с его значением при давлении в одну атмосферу. Если же произвести подсчет по уравнению Ван-дер-Ваальса, то разница значений RT при 1 и 1000 атм. не превышает нескольких процентов.
лучшее согласие с опытом, чем уравнение Клапейрона-менделеева. Так, для 1 моля азота при 00С и давлении 1000 атм произведение pV= RT вырастает в два с лишним раза по сравнению с его значением при давлении в одну атмосферу. Если же произвести подсчет по уравнению Ван-дер-Ваальса, то разница значений RT при 1 и 1000 атм. не превышает нескольких процентов.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 459; Нарушение авторских прав?; Мы поможем в написании вашей работы!