
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные и критические изотермы
|
|
|
|
График уравнения ван-дер-ваальса
Кривая уравнения Ван-дер-Ваальса при невысоких температурах имеет вид, показанный на рис. 88. Правая часть участка об весьма близка к изотерме закона Бойля— Мариотта. Действительно, при большом объеме газа обе поправки в уравнении Ван-дер-Ваальса невелики и левая часть уравнения близка к значению pV. По мере уменьшения объема поправки начинают играть заметную роль, При некотором объеме, которому соответствует точка б на графике, газ при обычных условиях начинает конденсироваться, образуется двухфазная система жидкость — насыщающий пар. Давление насыщающих паров зависит только от температуры, поэтому пока весь пар не превратится в жидкость, давление изменяться не будет, процесс конденсация изобразится изобарой — прямой бд, параллельной оси абсцисс. Точка д изображает окончание процесса конденсации: весь насыщающий пар превратился в жидкость. Дальнейшее очень незначительное уменьшение объема жидкости может быть получено лишь значительным увеличением давления, поэтому линия де, изображающая жидкое состояние, идет круто вверх. Точки прямой бд, за исключением точки пересечения ее с кривой вг, не описываются уравнением Ван-дер-Ваальса. Кривая бвгд изображает малоустойчивые или вовсе неустойчивые состояния вещества. При изотермическом расширении точки д и б соответствуют началу и концу кипения. Точка д соответствует кипящей жидкости, точка б – сухому насыщенному пару. Смесь кипящей жидкости и сухого насыщенного пара, которая существует в любой точке участка д б, называется влажным паром.
На рис. 24 приведены экспериментальные изотермы реального газа. Они отличаются от изотерм Ван-дер-Ваальса (см. рис. 23). Последние при низких температурах имеют минимумы (точка г) и максимумы (точка в). При некоторой (критической) температуре Ткр на изотерме имеется только точка перегиба К. При высоких температурах (Т > Ткр) изотермы Ван-дер-Ваальса похожи на изотермы идеального газа. На экспериментальных изотермах отсутствуют "волнообразные" участки. Вместо них у реальных изотерм имеется прямолинейный горизонтальный участок. Рассмотрим более подробно изотермы при Т4 (см. рис 24). Участок а-в изотермы Ван-дер-Ваальса и участок 1-2 реальной изотермы практически одинаковы. Это состояние ненасыщенного пара. Изотермы Ван-дер-Ваальса и реальные ведут себя различным образом в области расслоения на две фазы. Расслоение на две фазы объясняется неустойчивостью однородных состояний, отвечающих завитку бвгд (см.рис.3). Состояния, соответствующие участкам бв и гд, при известных условиях могут осуществляться. Однако эти состояния неустойчивы. Достаточно на участке бв попадания в пар пылинки, чтобы все вещество распалось на две фазы и перешло в состояние, изображаемое прямой 2-6 на рис. 24. Подобное состояние называется метастабильным. Вещество в состоянии гд называется пересыщенным паром.
На рис. 24 приведены изотермы для нескольких значений температуры. Из рисунков видно, что волнообразный участок 2-6 теоретической изотермы (рис. 23) и горизонтальный участок экспериментальных изотерм (рис. 24) сокращаются с повышением температуры и при критической температуре Ткр стягиваются в точку. При критической температуре полностью исчезает всякое различие между жидкостью и паром. Точка К называется критической точкой. Критическая температура Ткр — это такая температура, выше которой газ нельзя превратить в жидкость никаким давлением, а ниже которой газ можно превратить в жидкость при некотором давлении, тем меньшем, чем ниже температура. Объем Vкр и давление ркр, соответствующие критическому состоянию, называются критическими величинами. Из рис 24 видно, что давление насыщенного пара растет с температурой (точка 2 на каждой кривой), достигая при критической температуре значения ркр. При температурах выше критической понятие насыщенного пара теряет смысл.
Если провести линию через точки 2 и 6 соответственно на каждой изотерме (рис. 25), получается колоколообразная кривая. Она ограничивает область двухфазных состояний вещества. Эта кривая и участок критической изотермы (рис. 25), лежащий слева от точки -К, делит диаграмму (р, V) на три области. Область Ж — область однородных жидких состояний вещества. Область П + Ж — это область двухфазных состояний. Область Г — область однородного газообразного вещества. В последней можно выделить участок П, который называется областью пара. Вещество, находящееся в таком состоянии, при изотермическом сжатии превращается в жидкость. Решение уравнения (3) дает
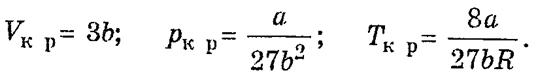 (3. 6)
(3. 6)
Таким образом, зная константы Ван-дер-Ваальса а и b, можно найти соответствующие критической точке величины коэффициенты а и b в уравнении Ван-дер-Ваальса и универсальную газовую постоянную R.
Рк = 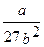 ,
,
Vmк =3b,
Тк = 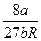 ;
;
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 776; Нарушение авторских прав?; Мы поможем в написании вашей работы!