
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплопроводность газов
|
|
|
|
Отсюда
Справа налево перенесено количество движения
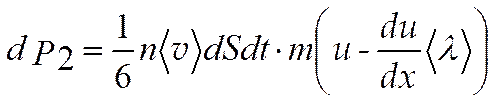 (4.11)
(4.11)
Полное изменение количества движения, dK = dK2-dK1, равно импульсу, переданному от одного слоя газа к другому:
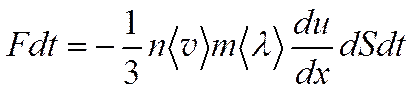 (4.12)
(4.12)
 (4.13)
(4.13)
Сравнивая (4.5) с формулой Ньютона (1), получим выражение для коэффициента внутреннего трения:
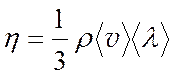 (4.14)
(4.14)
Подставив вместо l выражение для длины свободного пробега <l> = 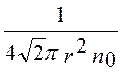 , получим
, получим
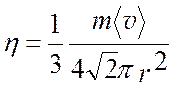 (4.15)
(4.15)
Отсюда видно, что коэффициент внутреннего трения для газов не зависит от числа молекул в единице объема, т. е. он не зависит от давления и плотности газа. Это очень важный результат. Можно менять давление в весьма широких пределах, а коэффициент внутреннего трения газа будет оставаться постоянным.
Это положение, однако, становится неверным для сильно разреженных газов, т. е. для таких газов, у которых длина свободного пробега молекулы больше, чем линейные размеры, сосуда, в котором заключен газ. В этом случае молекулы движутся от одной стенки сосуда до другой, не сталкиваясь друг с другом, длина свободного пробега l оказывается постоянной величиной, и формула (4.15) для расчета h становится неверной.
Мы предположили, что все молекулы имеют одинаковую среднюю скорость и. Если произвести более строгий расчет, учитывая максвелловское распределение скоростей, то вместо коэффициента 1/3 в формулах (5) и (6) появится коэффициент 0,31.
Рассмотрим газ, заключенный между двумя поверхностями, имеющими температуры T1 и Т2. Если эти температуры поддерживаются постоянными, то через газ установится стационарный поток теплоты. Для простоты, чтобы рассматривать одномерную задачу, поместим газ между двумя параллельными поверхностями и ось Х направим перпендикулярно к этим поверхностям. Тогда вдоль оси Х будет градиент температуры 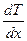 , вдоль осей У и Z, расположенных параллельно к ограничивающим газ поверхностям, температура не меняется. Рассмотрим поток теплоты через площадку dS = dydz, помещенную перпендикулярно к оси Х (рис. 29).
, вдоль осей У и Z, расположенных параллельно к ограничивающим газ поверхностям, температура не меняется. Рассмотрим поток теплоты через площадку dS = dydz, помещенную перпендикулярно к оси Х (рис. 29).
Температура в точке К, находящейся слева от площадки dS на расстоянии, равном средней длине свободного пробега молекулы 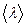 , равна
, равна
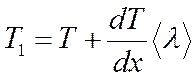 ; (4.16)
; (4.16)
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 448; Нарушение авторских прав?; Мы поможем в написании вашей работы!