
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Сколько граммов меди выделится на катоде при пропускании через раствор сернокислой меди СuSO4 тока силой 5 ампер в т
|
|
|
|
Пример 4
Решение
Пример 3
Решение
Пример 2
Решение
Пример 1
Сколько граммов меди выделится на катоде при пропускании через раствор сернокислой меди СuSO4 тока силой 5 ампер в течение 10 минут?
Определим количество протекшего через раствор электричества:
Q = I • t,
где I – сила тока в амперах;
t – время в секундах.
Q = 5A • 600 с = 3000 кулонов
Эквивалент меди (ат. масса 63,54) равняется 63,54: 2 = 31,77. Следовательно, 96500 кулонов выделяют 31,77 г меди. Искомое количество меди:
m = (31,77 • 3000) / 96500» 0,98 г
Сколько времени нужно пропускать через раствор кислоты ток силой 10 ампер, чтобы получить 5,6 л водорода (при н. у.)?
Находим количество электричества, которое должно пройти через раствор, чтобы из него выделилось 5,6 л водорода. Так как 1 г-экв. водорода занимает при н. у. объем 11,2л, то искомое количество электричества
Q = (96500 • 5,6) / 11,2 = 48250 кулонов
Определим время прохождения тока:
t = Q / I = 48250 / 10 = 4825 с = 1 ч 20 мин 25 с
При пропускании тока через раствор серебряной соли на катоде выделилось за 10 мин. 1 г серебра. Определите силу тока.
1 г-экв. серебра равен 107,9 г. Для выделения 1 г серебра через раствор должно пройти 96500: 107,9 = 894 кулона. Отсюда сила тока
I = 894 / (10 • 60)» 1,5A
Найти эквивалент олова, если при токе 2,5 ампера из раствора SnCl2 за 30 мин. выделяется 2,77 г олова.
Количество электричества, прошедшее через раствор за 30 мин.
Q = 2,5 • 30 • 60 = 4500 кулонов
Так как для выделения 1 г-экв. требуется 96500 кулонов, то эквивалент олова.
ЭSn = (2,77 • 96500) / 4500 = 59,4
Электрохимическая коррозия window.top.document.title = "7.5. Электрохимическая коррозия";
В основе коррозийных процессов лежат окислительно-восстановительные реакции металлов с окружающей средой, сопровождающиеся переходом металлов в более термодинамически устойчивое состояние.
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция
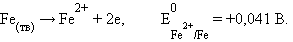
|
Катодная реакция – восстановление атмосферного кислорода:
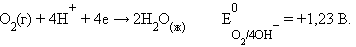
|
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
| 2Fe + O2 + 4H+ → 2FeO + 2H2O. |
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9–10 коррозия железа практически прекращается. Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+. Вторая стадия коррозии соответствует реакции образования гидратированного оксида железа (ржавчины) Fe2O3∙nH2O (рис. 7.4):
| 4Fe2+ + O2 + 4H2O + xH2O = 2Fe2O3∙xH2O + 8H+. |
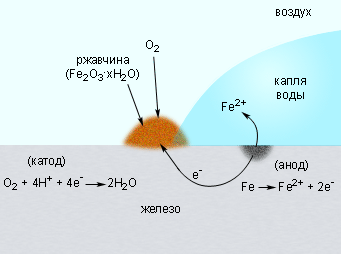
|
| Рисунок 7.4. Коррозия железа кислородом воздуха, растворенным в воде. |
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рис. 7.5).
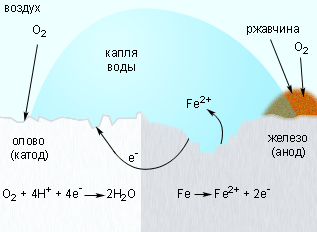
|
| Рисунок 7.5. Коррозия «белой жести». |
Оцинкованное железо ведет себя иначе. Поскольку цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рис. 7.6).
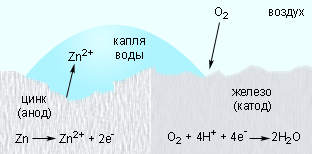
|
| Рисунок 7.6. Катодная защита в оцинкованном железе. |
Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
МЕТАЛЛЫ
Общие свойства
Щелочные металлы
Щелочноземельные металлы
Подгруппа алюминия
Переходные металлы
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 2768; Нарушение авторских прав?; Мы поможем в написании вашей работы!