
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая термодинамика, равновесие и кинетика химических реакций
|
|
|
|
Лекция 4
Химическая термодинамика – раздел физической химии, использующий законы термодинамики для описания процессов в химических системах – их направления и степени прохождения процесса.Предмет химии – химическая реакция. В результате химической реакции исчезают одни и образуются другие вещества. При этом обязательно выделяется или поглощается энергия. Таким образом, химическая реакция описывает, во-первых, строение и, во-вторых, энергию системы, испытывающей химическое превращение. «Химическая» энергия реакции невелика по сравнению с ядерными: при получении 1 кг сульфида железа из простых веществ (Fe + S = FeS) выделяется энергия около 1000 кДж. Этого хватит на нагрев 2 л воды от 0°С до 100°С при условии, что расход энергии на нагрев окружающей среды будет минимальным.
Все химические реакции по признаку поглощения или выделения теплоты можно разделить на два основных класса: эндотермические и экзотермические.
Реакцию, протекающую при постоянном объеме (в замкнутом реакторе), характеризуют внутренней энергией (U), а при постоянном давлении в открытом сосуде – энтальпией (Н). Для тех, кто проводит реакции в открытых сосудах, более важной величиной является энтальпия образования, обозначенная буквой Н (от англ. heat – теплота). Существует шкала, позволяющая сопоставлять энтальпии образования всех веществ. Принято, что нулю на данной шкале соответствуют простые вещества. Если простое вещество способно существовать в нескольких аллотропных формах, то ноль относится к наиболее устойчивой из них. Так, нулевую энтальпию образования имеет кислород, а не озон, графит, а не алмаз.
Если при образовании сложного вещества из простых энергия затрачивается, то значение энтальпии для данного вещества положительное, а если выделяется, то отрицательное. Поскольку абсолютную энтальпию образования вещества определить невозможно, оперируют только с их разностями  H в искусственно введенной шкале. Разница энтальпий образования соединений обычно зависит от температуры, при которой проводится процесс. В связи с этим в справочниках, как правило, указывают стандартное (относящееся к температуре 25 °С) значение энтальпии, что обозначают верхним индексом (0). Обозначение энтальпии образования соединения (из простых веществ) снабжают также нижним индексом (f) (от англ. formation – образование). Тогда для стандартной энтальпии образования воды имеем:
H в искусственно введенной шкале. Разница энтальпий образования соединений обычно зависит от температуры, при которой проводится процесс. В связи с этим в справочниках, как правило, указывают стандартное (относящееся к температуре 25 °С) значение энтальпии, что обозначают верхним индексом (0). Обозначение энтальпии образования соединения (из простых веществ) снабжают также нижним индексом (f) (от англ. formation – образование). Тогда для стандартной энтальпии образования воды имеем: 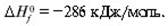
Кроме энтальпий образования в справочниках приводят и другие виды энтальпий, например, стандартные энтальпии сгорания, показывающие, сколько энергии выделяется при сгорании 1 моль вещества.
Энтальпия (русский эквивалент этого слова – «теплосодержание») системы возрастает в эндотермическом процессе (когда система поглощает теплоту),  Н > 0, и убывает в экзотермическом,
Н > 0, и убывает в экзотермическом,  Н < 0 (рис. 1).
Н < 0 (рис. 1).

|
| Рис. 1. Изменение энтальпии в эндо-и экзотермических процессах |
При этом выполняется закон Гесса: «Если химическая реакция проводится при постоянном давлении или постоянном объеме, то ее тепловой эффект не зависит от того, по какому пути (через образование каких промежуточных соединений) она осуществлена.» Тепловой эффект — это разница между уровнем энергии реагентов и уровнем энергии продуктов, которая, очевидно, зависит только от свойств участников реакции до нее и после. А путь может быть вообще неизвестен.
Энтальпии очень многих реакций найдены экспериментально, часто с использованием калориметров. Однако это осуществлено далеко не для всех процессов. Во-первых, их слишком много, возможно, практически бесконечное число. Во-вторых, отнюдь не все реакции можно провести в калориметре, например реакцию, происходящую в зеленых растениях.
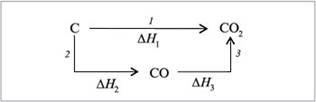
Легко пояснить закон Гесса с помощью следующего примера. Углекислый газ из углерода и кислорода можно получить двумя путями (рис. 2):
|
| Рис. 2. Графическое истолкование закона Гесса на примере превращения углерода в углекислый газ |
1) в одну стадию – прямым сжиганием в избытке кислорода;
2) в две стадии – получением сначала монооксида углерода и его последующим сжиганием.
Согласно закону Гесса:
 H 1 =
H 1 =  H 2 +
H 2 +  H 3.
H 3.
Из закона Гесса вытекают три важных следствия.
Следствие 1. Энтальпия реакции равна разности энтальпий образования продуктов и реагентов:
 H р =
H р = 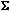
 Hf (прод.) –
Hf (прод.) – 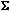
 Hf (реаг.).
Hf (реаг.).
Так, если уравнение реакции в общем виде записать следующим образом:
a А + b B = c C + d D, то
 H р = c
H р = c  Hf (C) + d
Hf (C) + d  Hf (D) – a
Hf (D) – a  Hf (A) – b
Hf (A) – b  Hf (B).
Hf (B).
Следствие 2. Энтальпия реакции равна разности энтальпий сгорания реагентов и продуктов:
 H р =
H р = 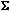
 H сг(реаг.) –
H сг(реаг.) – 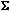
 H сг(прод.).
H сг(прод.).
Для реакции:
a А + b B = c C + d D,
 H р = a
H р = a  H сг(А) + b
H сг(А) + b  H сг(B) – c
H сг(B) – c  H сг(C) – d
H сг(C) – d  H сг(D).
H сг(D).
Следствие 3. Термохимические уравнения реакций можно складывать и вычитать, умножать и делить, записывать справа налево, несмотря на подчас практическую неосуществимость обратных реакций.
Это следствие приходит на помощь, когда соединения либо не удается получить при непосредственном взаимодействии простых веществ, либо они не горят.
Иногда вместо энтальпий реакций используют теплоты реакций, а вместо энтальпий образования веществ их теплоты образования. Теплоты реакций и теплоты образования связаны с соответствующими энтальпиями простым соотношением: Q = – H.
H.
|
|
|
Дата добавления: 2014-01-15; Просмотров: 715; Нарушение авторских прав?; Мы поможем в написании вашей работы!