
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики – это закон сохранения энергии, согласно которому энергия ниоткуда не берется и никуда не девается, а только переходит из одной формы в другую
|
|
|
|
Мы живем в мире, где большинство событий необратимо. Необратимо и большинство химических изменений в мире, так что мир изменяется самопроизвольнов некотором направлении. Что значит «самопроизвольно»?
Самопроизвольным называется процесс, происходящий без затраты работы. Наоборот, в его результате работа может быть получена. Р абота — это мера упорядоченной передачи энергии от одной системы к другой. Иная возможность передачи энергии — теплота — мера передачи энергии от одного тела к другому путем неупорядоченных, хаотических столкновений частиц веществ, образующих эти тела, — явление теплопроводности.
Всякая система стремится перейти в состояние с наименьшей энергией. Самопроизвольно происходят только экзотермические процессы.
Однако существование обратимых химических реакций, которые, если они экзотермичны в одном направлении, то эндотермичны в другом, опровергает это утверждение. Закон сохранения энергии гласит, что энергия Мира постоянна. Если энергия какой-либо системы понижается, то неминуемо в другой системе она повышается. Для объяснения происходящих в мире изменений необходимо установить физическую причину.
Мерой беспорядка (W) служит физическая величина – энтропияS: чем выше значение энтропии, тем больше беспорядка, и чем оно ниже, тем больше порядка. Для реальных веществ величина W невообразимо велика, так что оперировать ею чрезвычайно неудобно. На практике мерой вероятности существования системы в том или другом состоянии является энтропия S, связанная с W уравнением Больцмана:
S = k ln W,
где k = R / N A =1,38•10–23 Дж/К – константа Больцмана, ln W – натуральный логарифм величины термодинамической вероятности
С увеличением W — числа способов, которым может быть реализовано данное состояние вещества, – возрастает энтропия S.
Размерность энтропии определяется размерностью константы Больцмана. Для вещества величина энтропии обычно дается в расчете на 1 моль, тогда ее размерность Дж/(К•моль). Наименьшая энтропия у веществ в кристаллическом состоянии и максимальная у газов. Жидкость в этом отношении занимает промежуточное положение. Строение идеального кристалла при абсолютном нуле градусов Кельвина совершенно однозначно, т.е. W = 1 и в соответствии с уравнением Больцмана S = 0. В идеально упорядоченном состоянии при температуре абсолютного нуля энтропия вещества равна 0. Таким образом, зная структуру вещества, можно вычислить его энтропию.
Чем больше в системе вещества, тем больше ее энтропия. Чем выше температура, тем больше число энергетических состояний, в которых могут находиться частицы, образующие данное вещество, тем больше энтропия. Это изменение энтропии определяется формулой  S = Q/T, где
S = Q/T, где  S — изменение энтропии системы, Q — количество теплоты, поглощенной системой (тогда энтропия системы увеличивается,
S — изменение энтропии системы, Q — количество теплоты, поглощенной системой (тогда энтропия системы увеличивается,  S > 0) или потерянной ею (тогда энтропия системы уменьшается,
S > 0) или потерянной ею (тогда энтропия системы уменьшается,  S < 0), T — абсолютная температура.
S < 0), T — абсолютная температура.
Все изложенные выше наблюдения могут помочь второй закон термодинамики: в изолированной системе самопроизвольно протекающие процессы увеличивают энтропию системы. (На основании второго закона термодинамики возникла теория тепловой смерти Вселенной.)
Следствие из второго закона термодинамики – высокая степень упорядоченности в системе возможна при поступлении энергии и вещества из-за пределов системы.
Третий закон термодинамики устанавливает, что энтропия физической системы при стремлении температуры к абсолютному нулю не зависит от параметров системы и остается неизменной. (В формулировке М.Планка энтропия S = 0 при T = 0 К.)
Энтропия жидкости обычно гораздо выше, чем энтропия твердого тела, а энтропия газа выше, чем энтропия соответствующей жидкости. Это означает, что с точки зрения второго закона термодинамики жидкостью быть более выгодно, чем твердым телом, а газом – выгоднее, чем жидкостью.
Таким образом, для самопроизвольного протекания реакции требуется, с одной стороны, уменьшение суммы энтальпий: если сумма энтальпий образования продуктов меньше суммы энтальпий образования реагентов, т.е.  Н < 0, то такой процесс энергетически выгоден. С другой стороны, самопроизвольно может протекать лишь процесс, в котором сумма энтропий продуктов превышает сумму энтропий реагентов, т. е. изменение энтропии в ходе процесса должно быть положительным (
Н < 0, то такой процесс энергетически выгоден. С другой стороны, самопроизвольно может протекать лишь процесс, в котором сумма энтропий продуктов превышает сумму энтропий реагентов, т. е. изменение энтропии в ходе процесса должно быть положительным ( S > 0).
S > 0).
Возможно несколько вариантов изменения сумм энтальпий образования и энтропий веществ в ходе процесса.
1.  Н < 0,
Н < 0,  S > 0. Процесс однозначно энергетически выгоден и может протекать самопроизвольно.
S > 0. Процесс однозначно энергетически выгоден и может протекать самопроизвольно.
2.  Н > 0,
Н > 0,  S < 0. Процесс однозначно энергетически невыгоден и не может протекать самопроизвольно.
S < 0. Процесс однозначно энергетически невыгоден и не может протекать самопроизвольно.
3.  Н < 0,
Н < 0,  S < 0. Уменьшение
S < 0. Уменьшение  Н благоприятно для самопроизвольного протекания реакции, тогда как уменьшение
Н благоприятно для самопроизвольного протекания реакции, тогда как уменьшение  S препятствует этому. (Неясно, возможно ли самопроизвольное протекание такой реакции.)
S препятствует этому. (Неясно, возможно ли самопроизвольное протекание такой реакции.)
4.  Н > 0,
Н > 0,  S > 0. Увеличение
S > 0. Увеличение  Н не способствует самопроизвольному протеканию реакции, однако возрастание
Н не способствует самопроизвольному протеканию реакции, однако возрастание  S повышает ее вероятность. (Неясна возможность самопроизвольного протекания такой реакции.)
S повышает ее вероятность. (Неясна возможность самопроизвольного протекания такой реакции.)
Самопроизвольный процесс в некоторой системе (где изменения и энтропии, и энтальпии относятся только к рассматриваемой системе) возможен, если:
 S –
S –  H / Т > 0, или
H / Т > 0, или  H – T
H – T  S < 0. Значение этой функции (ее знак):
S < 0. Значение этой функции (ее знак):
 G =
G =  H – T
H – T  S и определяет направление процесса. Роль арбитра, определяющего возможность самопроизвольного протекания реакции при постоянном давлении, играет энергия Гиббса, где T – абсолютная температура, К.
S и определяет направление процесса. Роль арбитра, определяющего возможность самопроизвольного протекания реакции при постоянном давлении, играет энергия Гиббса, где T – абсолютная температура, К.
Функция состояния системы G называется энергией Гиббса, или изобарно-изотермическим потенциалом, или свободной энергией системы. В системе в качестве самопроизвольного возможен только тот процесс, в результате которого энергия Гиббса системы уменьшается,  G < 0.
G < 0.
При  G < 0 реакция может протекать самопроизвольно, а при
G < 0 реакция может протекать самопроизвольно, а при  G > 0 реакция термодинамически запрещена. Если
G > 0 реакция термодинамически запрещена. Если  G = 0, то реакционная система находится в состоянии равновесия (скорости прямой и обратной реакций равны).
G = 0, то реакционная система находится в состоянии равновесия (скорости прямой и обратной реакций равны).
Самопроизвольное протекание эндотермической реакции возможно лишь тогда, когда она сопровождается значительным увеличением энтропии.
Возможность или невозможность протекания реакции устанавливают с помощью уравнения Гиббса следующими способами.
1. Для температуры 25 °С на основе табличных данных рассчитывают  G 0 по соотношению:
G 0 по соотношению:
 G 0 =
G 0 =  Н 0– 298
Н 0– 298 S 0.
S 0.
2. Для температуры, отличающейся от 25 °С, расчет проводят по соотношению:
 G =
G =  G 0 + RT ln K р.
G 0 + RT ln K р.
K р при данной температуре можно найти, преобразовав выражение для равновесия
 G = 0
G = 0 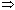
 G 0 + RT ln K р = 0
G 0 + RT ln K р = 0
к виду:
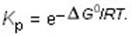
Это соотношение позволяет получить значение константы равновесия при любой температуре.
3. Для окислительно-восстановительных реакций выражение для энергии Гиббса при стандартных условиях принимает следующий вид:
 G 0 = – nF
G 0 = – nF 
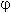 0, где n – количество передаваемых электронов, F – постоянная Фарадея (
0, где n – количество передаваемых электронов, F – постоянная Фарадея (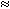 96 500Кл/моль),
96 500Кл/моль), 
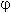 0 – ЭДС реакции. Из этого выражения следует, что реакция протекает при положительном значении ЭДС.
0 – ЭДС реакции. Из этого выражения следует, что реакция протекает при положительном значении ЭДС.
4. Из условия равновесия реакции ( G = 0) имеем:
G = 0) имеем:
0 =  Н – T
Н – T S. Отсюда Т =
S. Отсюда Т =  Н /
Н / S – температура, при которой реакция находится в состоянии равновесия.
S – температура, при которой реакция находится в состоянии равновесия.
Термодинамика позволяет в принципе оценить возможность протекания химических реакций. Однако она ничего не говорит о реальных скоростях их протекания. Так, термодинамические расчеты показывают, что реакция окисления целлюлозы кислородом воздуха должна самопроизвольно протекать при комнатной температуре, чего на практике не наблюдается. Причина состоит в том, что у молекул не хватает энергии для осуществления процесса за обозримое время. Проблему времени достижения состояния равновесия решает наука о скоростях химических реакций – химическая кинетика.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 2257; Нарушение авторских прав?; Мы поможем в написании вашей работы!