
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика. В результате химической реакции исчезают одни и образуются другие вещества
|
|
|
|
В результате химической реакции исчезают одни и образуются другие вещества. В процессе реакции изменяются количества вещества: как реагентов (исходных веществ), так и продуктов (конечных веществ). Скорость этого изменения называется скоростью химической реакции. Химическая кинетика – учение о скоростях и механизмах химических реакций. По числу взаимодействующих в реакции молекул различают реакции мономолекулярные, бимолекулярные и тримолекулярные. Например, диссоциация молекулярного йода на атомы: I2 = 2I – мономолекулярная реакция.
Взаимодействие йода с водородом: I2 + Н2 = 2HI – бимолекулярная реакция.
Закон действующих масс для химических реакций разной молекулярности записывается по-разному: для м ономолекулярных реакций А = В + С,
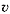 = kc A,
= kc A,
где k – константа скорости реакции;
для бимолекулярной реакции А + В = С, 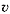 = kc A c В
= kc A c В
и для тримолекулярной реакции 2А + В = С, 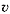 = kc 2A c В.
= kc 2A c В.
Таким образом, скорость химической реакции можно описать уравнением
r = 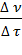 , (1)
, (1)
где r – скорость реакции (от англ. rate — скорость процесса, в отличие от ранее используемого обозначения для скорости реакции 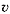 – velocity – скорость перемещения),
– velocity – скорость перемещения),  (прописная греч. дельта) – синоним слов «конечное изменение»,
(прописная греч. дельта) – синоним слов «конечное изменение», 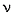 (греч. ню) – количество (моль) вещества-реагента или вещества-продукта,
(греч. ню) – количество (моль) вещества-реагента или вещества-продукта, 
 (греч. тау) – время (с), за которое произошло данное изменение.
(греч. тау) – время (с), за которое произошло данное изменение.
Описываемая уравнением (1) скорость реакции зависит от количеств взятых веществ-реагентов. Скорость химической реакции — это изменение количества вещества какого-либо участника реакции в единицу времени в единице реакционного пространства.
В гомогенной системе реакция происходит во всем объеме V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции, то уравнение имеет вид:
r = ± 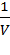 ∙
∙ 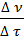 = ±
= ± 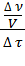 = ±
= ± 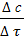 , (2)
, (2)
где с — молярная концентрация вещества (моль/л).
Скорость реакции — изменение концентрации вещества в единицу времени.
В гетерогенной системе (например, при горении твердого тела в газе или при взаимодействии металла с кислотой) реакция происходит на границе раздела между компонентами. Если площадь этой границы S, то уравнение скорости имеет вид:
r = ± 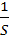 ∙
∙ 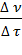 , (3)
, (3)
Очевидно, что при таком определении (см. уравнения (2) и (3)) величина скорости реакции не зависит от объема в гомогенной системе и от площади соприкосновения реагентов (степени измельчения) в гетерогенной системе.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 436; Нарушение авторских прав?; Мы поможем в написании вашей работы!