
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры. Энергия активации
|
|
|
|
Влияние концентраций реагентов
Влияние природы реагентов
Факторы, влияющие на скорость химической реакции
| Увеличивают скорость | Уменьшают скорость |
| Наличие химически активных реагентов | Наличие химически неактивных реагентов |
| Повышение концентрации реагентов | Понижение концентрации реагентов |
| Увеличение поверхности твердых и жидких реагентов | Уменьшение поверхности твердых и жидких реагентов |
| Повышение температуры | Понижение температуры |
| Присутствие катализатора | Присутствие ингибитора |
При замене серной кислоты (сильной кислоты) на уксусную (слабую кислоту) скорость реакции кислоты с металлом во всех случаях существенно замедляется. Можно сделать вывод, что на скорость реакции металла с кислотой влияет природа обоих реагентов – как металла, так и кислоты.
Чем выше концентрация вещества, тем больше частиц в единице объема, тем чаще они сталкиваются. Количественно это выражается так называемым законом действующих масс – скорость реакции пропорциональна концентрациям реагентов в некоторых степенях. Например, для следующих ниже уравнений реакций выражения скорости такие: А = С, r = kс A;
| А + В = С, А + 2В = С, | r = kс A с В; r = kс A с В с B = kс A с В2. |
Величина k – коэффициент пропорциональности – называетсяконстантой скорости реакции и не зависит от концентраций. Численно этот коэффициент равен скорости реакции, если произведение концентраций реагентов равно 1. Когда сравнивают скорости разных реакций, то сравнивают именно их константы скоростей.
Скорость реакций, протекающих в несколько последовательных стадий, определяется самой медленной из этих стадий. Вспомним арабскую поговорку: «Караван идет со скоростью самого медленного верблюда». Например, реакция
2Fe2+ + H2O2 = 2FeOH2+ протекает по следующим стадиям:
1) Fe2+ + H2O2 = FeOH2+ + OH•, k 1 = 60 л/(моль•с);
2) OH• + Fe2+ = FeOH2+, k 2 = 60 000 л/(моль•с).
Более медленная стадия – первая. Поэтому уравнение скорости данной реакции – r = k 1 c (Fe2+) c (H2O2), a не r = kc 2(Fe2+) c (H2O2).
Влияние температуры на протекание химической реакции двояко. Во-первых, температура может влиять на состав продуктов, может изменить не только ее скорость, но и ее путь, т.е. привести к другим продуктам. Во-вторых, подавляющее большинство реакций ускоряются при увеличении температуры.
Из физики известно, что скорость движения молекул газа пропорциональна корню квадратному из температуры:
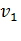 /
/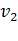 =
= 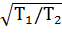
Повышение температуры, например от 250 С до 350 С, вызовет увеличение скорости движения молекул и, следовательно, числа столкновений в 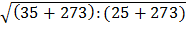 = 1,02 раза. А что говорит правило Вант-Гоффа?
= 1,02 раза. А что говорит правило Вант-Гоффа?
Действительная роль повышения температуры в ускорении реакций заключается в том, что с повышением температуры быстро, экспоненциально, растет число так называемых «активных» молекул, т.е. молекул, обладающих энергией, большей, чем энергия активации. При повышении температуры на десять градусов скорость увеличивается в число раз, равное температурному коэффициенту скорости γ:
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 736; Нарушение авторских прав?; Мы поможем в написании вашей работы!