
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гетерогенна рівновага у системі розчин-осад
.
Сучасні поняття молю, еквівалента. Кількість речовини. Засоби вираження концентрації. Молярна та еквівалентна концентрація, титр, титр за визначуваною речовиною. Розчин як середовище проведення реакції між іонами. Сучасні уявлення щодо електролітичної дисоціації. Гідратна теорія розчинів. Властивості розчинів слабких електролітів. Константа дисоціації слабких кислот та основ. Закон розведення. Властивості розчинів сильних електролітів. Іонна сила розчинів. Активність.
Одиниця кількості речов ини - 1 моль, це така кількість, яка містить 6,02*1023 умовних одиниць (атомів, молекул, іонів, функціональних груп).
Молярна маса М – це маса одного молю речовини. Розмірність молярної маси – г/моль.
Еквівалент – це умовна одиниця речовини, яка в даній кислотно-основній реакції еквівалентна(рівноцінна) одному іону гідрогену, а в даній окисно-відновній реакції – одному електрону. Еквівалент – безрозмірна величина і може змінюватися для однієї і тієї ж речовини в залежності від реакції, в якій приймає участь дана речовина.
Моль-еквівалентів, як і моль часток, містить 6,02*1023 еквівалентів.
Фактор еквівалентності f екв– це число яке показує яка доля реальної частки речовини еквівалентна одному іону гідрогену в реакціях кислотно – основних, чи одному електрону в реакціях окиснення – відновлення. Фактор еквівалентності розраховується на основі стехіометричного рівняння реакції.
Молярна маса еквівалента Мекв, г/моль-екв. – це маса одного моль-еквівалента цієї речовини і дорівнює:
Мекв = fекв* М.
Зауважимо, що молярна маса речовини це величина абсолютна і для даної речовини незмінна, а молярна маса еквіваленту величина відносна і залежить від конкретної реакції в якій приймає участь дана речовина.
Наприклад, для кислотно-основної реакції:
NaОH + H3PO4  = NaН2PO4 + H2O,
= NaН2PO4 + H2O,
фактор еквівалентності H3PO4 - f екв(H3PO4) дорівнює 1, молярна маса еквіваленту:
Мекв (1 H3PO4) = f екв(H3PO4)* М (H3PO4) = 1*98 г/моль =98 г/моль-екв.
Для реакції:
2NaОH + H3PO4  = Na2НPO4 + 2H2O,
= Na2НPO4 + 2H2O,
відповідно:
Мекв (1/2 H3PO4) = f екв(H3PO4)* М (H3PO4) = (1/2)*98 г/моль =49 г/моль-екв.
Для реакції:
3NaОH + H3PO4  = Na3PO4 + 3H2O,
= Na3PO4 + 3H2O,
відповідно:
Мекв (1/3 H3PO4) = f екв(H3PO4)* М (H3PO4) = (1/3)*98 г/моль =32,66 г/моль-екв.
Для окисно-відновної реакції:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Cu0 -2e = Cu2+ І 3
6e
N+5 + 3e = N+2 І 2,
фактор еквівалентності f екв (Cu) = 3/6 =1/2, молярна маса еквіваленту купруму:
Мекв (1/2 Cu) = f екв(Cu)* М (Cu) = ½*63,54г/моль =31,77г/моль.
Для нітратної кислоти: f екв (HNO3) = 8/6=4/3. молярна маса еквіваленту:
Мекв (4/3 HNO3) = 4/3 М =4/3*63 = 84 г/моль-екв.
Аналогічно можна розрахувати фактори еквівалентності і молярні маси еквіваленту усіх інших учасників реакції. Варто лише мати на увазі, що розраховувати фактори еквівалентності треба за одними правилами.
Засоби вираження концентрації розчинів. Концентрація характеризує кількість речовини в одиниці об’єму. Особливо це важливо для речовин в розчинах. Одиницями маси використовуються кг чи г, одиницями об’єму м3, дециметр кубічний - дм3, який точно відповідає 1 літру(л) і кратні одиниці, наприклад мілілітр (мл) = 10-3 л.
Молярна концентрація Cм - число моль розчиненої речовини, які містяться у 1 л розчину. Молярна концентрація розраховується за формулою:
Cм =
 , моль/л,
, моль/л,
де mpp – маса розчиненої речовини, г;
Мрр – молярна маса розчиненої речовини, г/моль;
V – об’єм розчину, л.
Іноді скорочена молярну концентрацію зазначають великою буквою М.
Нормальна, або еквівалентна концентрація N - число моль-еквівалентів розчиненої речовини, яка приймає участь у даній реакції, що міститься в 1 л розчину. Є найбільш часто застосовуваним способом вираження концентрації в аналітичній хімії, особливо в титрометричному аналізі, тому що речовини взаємодіють в еквівалентних відношеннях, от же, розчини однакової еквівалентної концентрації реагують в однакових об’ємах. Еквівалентна концентрація розраховується за формулою:
N =
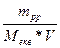 , моль-екв/л,
, моль-екв/л,
де mpp – маса розчиненої речовини, г;
Мекв – молярна маса еквіваленту розчиненої речовини, г/моль-екв;
V – об’єм розчину, л.
Іноді скорочено еквівалентну концентрацію зазначають малою буквою н.
Масова концентрація – відношення маси розчиненої речовини до об’єму розчину. Якщо масу розчиненої речовини виразити в грамах, а об’єм розчину в мл, то в аналітичній хімії така одиниця концентрації зветься титром (Т):
Т = 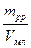 , г/мл.
, г/мл.
В хімічному об’ємному аналізі також застосовується така одиниця концентрації як титр стандартного розчину за визначуваною речовиною (складний титр) Тст.р/вр – це маса визначуваної речовини в грамах - mвр, яка взаємодіє з 1 мл стандартного розчину – Vст.р, у точці еквівалентності в мл:
Тст.р/вр = 
 , гвр/млст..р.
, гвр/млст..р.
Іноді склад розчину визначають у долі компонента від загальної кількості речовини. В залежності від одиниць вимірювання розрізняють масову, об’ємну і молярну долі. Долю виражають у процентах, міліонних долях – 10-6 (ppm), міліардних – 10-9 (ppb), тріліонних – 10-12 (ppt). Масова доля, яка виражена у процентах, звуть ще процентною концентрацією:
 *100%,
*100%,
де mpp – маса розчиненої речовини, г;
mрозч. - маса розчину, г.
В аналітичній хімії аналізи виконують головним чином у розчинах. За своїми властивостями у розчинах всі речовини поділяють на електроліти і не електроліти. Частіш за усе в аналітичній хімії мають справу з кислотами, лугами, солями, які є електролітами. Електроліти розпадаються у розчинах на позитивно і негативно заряджені частки – катіони і аніони. Теорія електролітичної дисоціації була розроблена Арреніусом і розвинута на основі гідратної теорії розчинів. У сучасному порозумінні електролітична дисоціація це процес розпаду електроліту на іони під дією полярних молекул розчинника. При цьому утворюються нестійкі сполуки іонів з молекулами розчинника – сольвати. Якщо розчинник вода – то гідрати.
В залежності від природи електроліти розпадаються на іони по різному. Спроможність електроліту розпадатися на іони характеризує ступінь електролітичної дисоціації 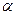 - відношення числа молекул електроліту, які розпалися на іони
- відношення числа молекул електроліту, які розпалися на іони  , до загальної кількості молекул електроліту
, до загальної кількості молекул електроліту  :
:
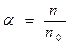 .
.
За ступенем дисоціації розрізняють:
Сильні електроліти 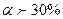 - HCl, HNO3, NaOH, KOH, майже усі солі.
- HCl, HNO3, NaOH, KOH, майже усі солі.
Середньої сили  - HNO2, H2SO3, H3PO4.
- HNO2, H2SO3, H3PO4.
Слабкі  - HCN, H2S, CH3COOH, NH4OH та інші.
- HCN, H2S, CH3COOH, NH4OH та інші.
Слід зазначити що такий розподіл умовний внаслідок залежності ступеню електролітичної дисоціації від концентрації.
У розчинах слабкі і сильні електроліти ведуть себе по різному. В водних розчинах сильних електролітів існують тільки гідратовані іони – катіони і аніони і відсутні молекули. У водних розчинах слабких електролітів розчинена речовина може існувати як у вигляді гідратованих іонів, так і у вигляді недисоційованих молекул.
Розчини слабих електролітів підпорядковуються закону діючих мас. Якщо розглянути дисоціацію оцтової кислоти:
CH3COOH CH3COO- + H+,
CH3COO- + H+,
то константа рівноваги, яка у цьому випадку зветься константою дисоціації, або константою іонізації, має вигляд:
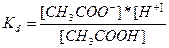 .
.
Якщо початкова концентрація оцтової кислоти С, а ступень дисоціації 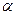 , то рівноважні концентрації складуть: [CH3COO-]=[H+] =
, то рівноважні концентрації складуть: [CH3COO-]=[H+] = , [CH3COOH]=C-
, [CH3COOH]=C- . Підставляючи це в рівняння для константи дисоціації отримаємо:
. Підставляючи це в рівняння для константи дисоціації отримаємо:
 .
.
Оскільки 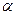
 , то у знаменнику цією величиною можна знехтувати.
, то у знаменнику цією величиною можна знехтувати.
Звідси визначаємо ступінь дисоціації:
Це вираз закону розбавлення Оствальду: з розбавленням 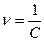 ступінь дисоціації електроліту збільшується.
ступінь дисоціації електроліту збільшується.
Розчини сильних електролітів закону діючих мас не підпорядковуються.
В розчинах сильних електролітів в порівнянні з розчинами слабих електролітів тієї ж концентрації значно більше концентрація іонів і має місце значний вплив електростатичної взаємодії між іонами що обумовлює меншу рухливість, а отже і меншу їх активність. Дійсно, якщо виміряти електропровідність, то в розчині сильного електроліту вона буде менше ніж повинна бути для розчину цієї концентрації. Тож сильний електроліт проявляє себе у розчині не відповідно реальній концентрації, а з нижчою, яку звуть уявляємою. Для врахування цього замість концентрації С для сильних електролітів ввели поняття активність 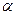 – це уявляєма концентрація сильного електроліту згідно якої він проявляє себе хімічно у розчині. Активність і концентрація пов’язані між собою через коефіцієнт активності f:
– це уявляєма концентрація сильного електроліту згідно якої він проявляє себе хімічно у розчині. Активність і концентрація пов’язані між собою через коефіцієнт активності f:
 .
.
Мірою електростатичної взаємодії між іонами є іонна сила розчину  яка залежить від присутності усіх іонів(їх концентрації С і заряду z) в даному розчині і розраховується за формулою:
яка залежить від присутності усіх іонів(їх концентрації С і заряду z) в даному розчині і розраховується за формулою:
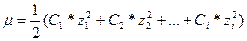 .
.
Коефіцієнт активності для сильно розбавлених розчинів розраховується для кожного іону за приблизною формулою Дебая і Хюккеля:
 .
.
Таким чином, якщо в рівняння для закону діючих мас замість концентрацій ввести активності, то отримуємо рівняння, які придатні для розчинів сильних електролітів, розчинів слабих електролітів в присутності сильних і концентрованих розчинів слабих електролітів:
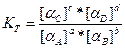 .
.
Константи дисоціації, які визначені за допомогою активності, називають термодинамічними, або істинними константами дисоціації.
Контрольні питання до теми 1.6
6.1.Що таке фактор еквівалентності?
6.2.Як розраховується молярна маса еквіваленту?
6.3.Як розраховується титр розчину?
6.4Як розраховується титр стандартного розчину за визначуваною речовиною?
6.5.Як ступінь дисоціації залежить від константи дисоціації?
6.6.Що таке активність?
6.7.Як розраховується іонна сила розчину?
6.8.Як розраховується коефіцієнт активності?
Дата добавления: 2014-01-15; Просмотров: 1460; Нарушение авторских прав?; Мы поможем в написании вашей работы!