
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сіль, утворена катіоном одно кислотної сильної основи і аніоном одноосновної слабкої кислоти
Розглянемо розчин у якому знаходиться сіль KCN, що піддається гідролізу. У цьому розчині перебігають такі реакції:
Реакція дисоціації солі як сильного електроліту: КСN  K+ + CN-.
K+ + CN-.
Реакція дисоціації води як слабкого електроліту: H2O 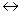 H+ + OH-.
H+ + OH-.
Сумарна реакція: КСN + H2O 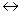 KOH + HCN.
KOH + HCN.
Сумарна реакція у іонному вигляді: СN- + H2O 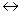 OH- + HCN.
OH- + HCN.
Кажуть, що така сіль гідролізується по аніону. Внаслідок зв’язування у слабкий електроліт HCN іонів гідрогену зміщується рівновага процесу дисоціації води, в розчині накопичуються іони ОН-, і середовище розчину набуває лужну реакцію (рН>7).
Константа рівноваги для цієї реакції має вигляд:
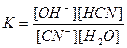 .
.
Зважаючи на те, що реакція проходить у водному середовищі, зміною концентрації Н2О можна знехтувати, прирівняти рівноважну концентрацію води її загальній концентрації [H2O] ≈ CH2O, яка залишається постійною. Тому можна записати:
 = Кг,
= Кг,
К*СН2О = Кг – константа гідролізу.
Якщо в це рівняння замість [OH−] підставити її значення, що витікає з рівняння іонного добутку води [OH−] = Kw/[H+], то отримаємо:
 =
= , Кк =
, Кк = 
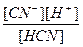 .
.
Кк - константа дисоціації кислоти HCN 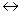 H+ + CN-.
H+ + CN-.
З реакції гідролізу витікає, що рівноважні концентрації продуктів гідролізу дорівнюють одна одній [HCN] = [OH−] = Сг =hг*С0. Рівноважна концентрація солі, що не прогідролізувалась, дорівнює різниці між загальною концентрацією солі C0 і концентрацією солі, що прогідролізувалась:
[CN−] = C0 - Сг = C0 - hг*С0.
Підставляючи ці значення до рівняння для константи гідролізу,маємо:

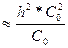 = hг2*С0.
= hг2*С0.
Тому що hг <<1. Тоді:
hг = =
=  .
.
Таким чином ступінь гідролізу тим більше, чим більше Kw, яке збільшується зі збільшенням температури, чим менше С0 (чим більше розведення),а також чим менша константа дисоціації, Кк (чим слабше кислота тим більша ступінь гідролізу і тим більше середовище розчиненої солі відрізняється від нейтрального).
Розрахуємо концентрацію іонів гідрогену і рН розчину солі, що гідролізується:
 =
=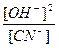 =
=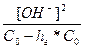
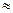

Вирішив рівняння відносно [OH−], отримаємо:
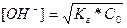 =
= .
.
Підставив замість [OH−] її значення з рівняння іонного добутку води [OH−] = Kw/[H+], маємо:
 .
.
Звідки отримаємо рівняння для розрахунку рН у розчині такої солі:
рН = 7 + 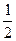 рКк +
рКк +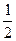 lgC0..
lgC0..
Дата добавления: 2014-01-15; Просмотров: 338; Нарушение авторских прав?; Мы поможем в написании вашей работы!