
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сіль, утворена катіоном одно кислотної слабкої основи і аніоном одноосновної сильної кислоти
|
|
|
|
Для розчину NH4Cl:
Реакція дисоціації солі як сильного електроліту: NH4Cl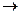 NH4+ Cl-
NH4+ Cl-
Реакція дисоціації води як слабкого електроліту: H2O 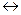 H+ + OH-.
H+ + OH-.
Сумарна реакція: NH4Cl + H2O 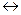 NH4OH + HCl.
NH4OH + HCl.
Сумарна реакція у іонному вигляді: NH4+ + H2O 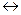 NH4OH + H+.
NH4OH + H+.
Кажуть, що така сіль гідролізується по катіону. Внаслідок зв’язування у слабкий електроліт NH4ОН іонів гідроксилу зміщується рівновага процесу дисоціації води, в розчині накопичуються іони Н+, і середовище розчину набуває кислу реакцію (рН<7).
Константа рівноваги для цієї реакції має вигляд:
 .
.
Аналогічно попереднему концентрація іонів гідрогену:
 ,
,
де С0 – концентрація солі, Косн – константа дисоціації основи.
рН у розчині такої солі розраховується за формулою:
рН = 7 - 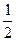 рКосн -
рКосн -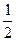 lgC0.
lgC0.
Сіль, утворена катіоном одно кислотної слабкої основи і аніоном одноосновної слабкої кислоти. Така сіль гідролізується комбіновано і по катіону і по аніону. Наприклад для CH3COONH4:
Реакція дисоціації солі: CH3COONH4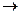 CH3COO- + NH4+.
CH3COO- + NH4+.
Реакція дисоціації води як слабкого електроліту: H2O 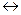 H+ + OH-.
H+ + OH-.
Сумарна реакція: CH3COONH4 + H2O 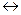 CH3COOН + NH4ОН.
CH3COOН + NH4ОН.
Концентрація іонів гідрогену розраховується за формулою:
 .
.
рН у розчині такої солі розраховується за формулою:
рН = 7 + 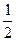 рКк -
рКк - 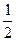 рКосн.
рКосн.
В залежності від співвідношення констант дисоціації кислоти і основи середовище у розчині такої солі може бути нейтральним (Кк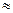 Косн), кислим (Кк>Косн) і лужним (Кк <Косн).
Косн), кислим (Кк>Косн) і лужним (Кк <Косн).
Сіль, утворена катіоном одно кислотної сильної основи і аніоном одноосновної сильної кислоти. Така сіль гідролізу не підкоряється (наприклад NaCl), оскільки не має взаємодії між компонентами розчину(не утворюються малодисоційовані чи малорозчинні сполуки), рН розчину нейтральне, а отже немає і гідролізу.
Гідроліз солей слабких багато основних кислот перебігає ступінчате:
І. K2CO3 + H2O 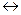 KHCO3 + KOH, KI =4,5*10-7
KHCO3 + KOH, KI =4,5*10-7
ІІ. KHCO3 + H2O 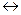 H2CO3 + KOH, KII=4,8*10-11
H2CO3 + KOH, KII=4,8*10-11
Гідроліз по першому ступеню перебігає більш ніж по другому.
Для кислих солей багато основних слабких кислот концентрація іонів гідрогену у розчині при гідролізі не залежить від концентрації солі, а визначається лише константами дисоціації кислоти за першим і другим ступенями. Наприклад для гідролізу KHCO3:
KHCO3 + H2O 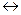 H2CO3 + KOH,
H2CO3 + KOH,
[H+] =  .
.
Гідроліз солей багато кислотних слабких основ також перебігає ступінчате:
FeCl3 + H2O 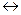 Fe(OH)Cl2 + HCl,
Fe(OH)Cl2 + HCl,
Fe(OH)Cl2 + H2O 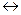 Fe(OH)2Cl + HCl,
Fe(OH)2Cl + HCl,
Fe(OH)2Cl + H2O 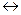 Fe(OH)3 + HCl,
Fe(OH)3 + HCl,
Солі, утворені катіонами багато кислотних слабких основ і аніонами багато основних слабких кислот. Такі солі підкоряються гідролізу і він перебігає повністю оскільки утворюються малорозчинні і газоподібні сполуки, які видаляються з зони реакції. Тому такі солі існують лише у твердому стані. Наприклад:
Al2S3 + 6H2O 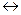 2Al(OH)3 + 3H2S.
2Al(OH)3 + 3H2S.
Крім природи сполуки на гідроліз можна впливати зміненням концентрації розчину; зміненням температури розчину; додаванням до розчину солі іншого гідролізуючого електроліту чи кислот або луг.
Таким чином під гідролізом розуміють взаємодію різноманітних сполук з іонами води, яка супроводжується порушенням рівноваги електролітичної дисоціації води зі зміненням рН розчину. Якщо такої взаємодії немає – не має і гідролізу.
|
|
|
Дата добавления: 2014-01-15; Просмотров: 596; Нарушение авторских прав?; Мы поможем в написании вашей работы!