
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С комплексні сполуки і колоїдні системи у хімічному аналізі
|
|
|
|
.
Стандартні електродні окислювально-відновні потенціали. Вимірювання та розрахунок потенціалів редокс систем. Вплив різних факторів на величину окисно-відновних потенціалів та напрямок окисно-відновних реакцій. Складання рівнянь реакції іонно-електронним методом. Використання цих реакцій в аналітичній хімії.
РЕАКЦІЇ ОКИСЛЕННЯ-ВІДНОВЛЕННЯ
Окислювально-відновними звуть реакції що перебігають зі зміненням ступеню окиснення реагуючих речовин і супроводжуються переходом електронів від одних елементів до інших. Окисником зветься речовина у склад якої входить атом елемента що приєднує електрони (ступінь окиснення зменшується). У процесі окисно-відновної реакції окисник відновлюється. Відновник – атом елемента, що віддає електрони. Відновник у процесі окисно-відновної реакції окислюється (ступень окиснення збільшується). Таким чином для перебігання окисно-відновної реакції необхідна участь як мінімум двох окислювальне відновних систем, які звуться окисно-відновними парами (редокс парами). Редокс пара – окислена Ох і відновлена Red форми одного і того ж елементу, наприклад Ох / Red. Окислена форма є окисником, а відновлена – відновником. У загальному вигляді окисно-відновну реакцію можливо визначити схемою:
Ox1 + Red2 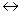 Red1 + Ox2,
Red1 + Ox2,
де: Ox1/Red1, Ox2/ Red2 - відповідно редокс пари першого і другого елементів.
Кожна редокс пара має більшу чи меншу окислювальну спроможність. Кількісно мірою спроможності електронів до переходу від відновника до окисника є електрорушійна сила (ЕРС) гальванічного елемента, складеного із полу елементів. Ця ЕРС є різниця рівноважних потенціалів обох полу елементів, які її складають. Відомо, що чим більш позитивним є окисно-відновний потенціал, тим більш сильно проявляються окислювальні спроможності окисної форми, і чим він більш негативний – тим у більшій мірі проявляються відновні властивості відновника.
Розрізняють стандартний і реальний редокс потенціали.
Стандартним потенціалом даної редокс пари Е0 вважають ЕРС гальванічного елементу, складеного з досліджуваного електроду при концентраціях окисною і відновної форм 1 моль/л, температурі 250С і стандартного водневого електроду, потенціал якого прийнято за 0:
Е02Н+/Н2 = 0.
На рисунку 1.2 надана схема гальванічного елементу для вимірювання стандартного окисно-відновного потенціалу для редокс пари Fe3+/Fe2+.
Величина стандартного потенціалу залежить від природи редокс пари і може бути більше і менше нуля (негативною і позитивною). Значення стандартних потенціалів наведені у довідниках. У таблиці 1.9 представлені стандартні потенціали деяких редокс пар у водних розчинах.
Реальний потенціал залежить від деяких факторів. Ця залежність підпорядковується рівнянню Нернста:
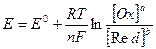 ,
,
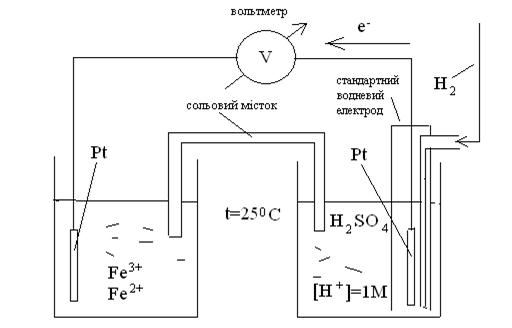
Рисунок 1.2 – Схема для визначення стандартного окисно-відновного потенціалу редокс пари Fe3+/Fe2+.
Таблиця 1.9 - Стандартні електродні потенціали у водних розчинах
| Редокс пара | Рівняння процесу (іонно-електронна полу реакція) | Е0, В |
| S2O82-/2SO42- | S2O82- + 2e = 2SO42- | + 2,010 |
| H2O2/ H2O | H2O2 + 2H+ + 2e = 2H2O | +1,770 |
| MnO4-/Mn2+ | MnO4-+8 H++5e=Mn2++4H2O | +1,510 |
| Cl2/2Cl- | Cl2 + 2e = 2Cl- | +1,359 |
| Cr2O72-/2Cr3+ | Cr2O72-+14H++6e=2Cr3++7H2O | +1,333 |
| NO3-/NO | NO3- +4H++3e = NO + 2H2O | +0,960 |
| O2/H2O | O2 + 4H+ + 4e = 2 H2O | +1,229 |
| O2/H2O(10-7M) | O2 + 4H+ + 4e = 2 H2O | +0,815 |
| Ag+/Ag | Ag+ + 1e = Ag | +0,799 |
| MnO4-/MnO2 | MnO4-+2H2O+3e = MnO2+4OH- | +0,600 |
| MnO4-/MnO42- | MnO4- + 1e = MnO42- | +0,560 |
| Fe3+/Fe2+ | Fe3+ +1e = Fe2+ | +0,771 |
| Fe3+/Fe | Fe3+ +3e = Fe | -0,036 |
| Fe2+/Fe | Fe2+ +2e = Fe | -0,440 |
| Sn4+/Sn2+ | Sn4+ + 2e = Sn2+ | +0,150 |
| Сu2+/Cu | Сu2+ + 2e = Cu | +0,345 |
| Сu2+/Cu+ | Сu2+ + 1e = Cu+ | +0,159 |
Сu2+/CuI
| Сu2+ + I- + 1e = CuI | +0,860 |
| I2/2I- | I2 + 2e = 2I- | +0,536 |
| S4O6/S2O3 | S4O6 + 2e = 2S2O3 | +0.090 |
| S/S2- | S + 2e = S2- | -0,480 |
| SO42-/SO32- | SO42-+H2O+2e=SO32-+2OH- | -0,930 |
де Е0 – стандартний редокс потенціал;
R – універсальна газова стала:
T - абсолютна температура;
n – число прийнятих чи відданих електронів;
F – стала Фарадея;
[ Ox ] – активність (концентрація у розведених розчинах) окисної форми;
[ Red ] – активність (концентрація розведених розчинів) відновленої форми;
a,b – стехіометричні коефіцієнти.
При підстановці числових значень і переходу до десятинних логарифмів, отримаємо при 250С:
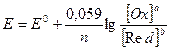 .
.
Якщо в реакції беруть участь іони водню або гідроксилу, їх концентрація також входить у рівняння Нернсту:
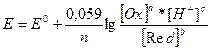 .
.
Реальний потенціал також залежить від наявності осаджувачів чи лігандів, які змінюють концентрації окисної чи відновної форм в рівновазі.
Порівнюючи стандартні потенціали редокс пар можливо вирішити питання о принциповій можливості перебігання реакції і її напрямку.
Принципова можливість перебігання окисно-відновної реакції буде при різних окисно-відновних потенціалах редокс пар. Якщо окисно-відновні потенціали однакові, реакція неможлива.
Зі збільшенням значення Е0 збільшується сила окислювача (окисненої форми) і зменшується сила відновника (відновленої форми). Тому для взятих редокс пар більш сильний окисник (окиснена форма редокс пари з більш позитивним потенціалом) буде відбирати електрони у більш сильного відновника (відновлена форма редокс пари з більш негативним потенціалом) і при цьому будуть утворюватися більш слабкі окисник і відновник. Наприклад, для двох редокс пар:
Cl2/2Cl- E0 = + 1,36B
Fe3+/Fe2+ E0 = + 0,77B
окисником буде Cl2, а відновником Fe2+ і напрямок реакції буде наступним:
Cl2 + 2Fe2+ = 2Cl- + 2Fe3, але не
2Fe3 + 2Cl- = 2Fe2+ + Cl2.
В аналітичній хімії для складання окисно-відновних реакцій і підбору коефіцієнтів користуються методом іонно-електронних пів реакцій. Іонно-електронна пів реакція – це запис реакції для певної редокс пари з відображенням окисної, відновної форм, числа прийнятих окисною формою електронів, а також стехіометричних коефіцієнтів і інших учасників реакції. Наприклад, для редокс-пари MnO4-/Mn2+, іонно-електронна пів реакція:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O.
При складанні рівняння окисно-відновної реакції цим методом дотримуються наступних правил.
1.Вирішують принципову можливість перебігання реакції, порівнюючи значення окисно-відновних потенціалів редокс пар, які беруть участь у реакції. Різниця між ними не повинна дорівнювати 0.
2.Знаходять окисник і відновник за правилом: окисник - окиснена форма редокс пари з більш позитивним потенціалом, відновник - відновлена форма редокс пари з більш негативним потенціалом.
Якщо:
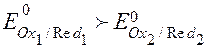 ,
,
тоді Ох1 окисник, а Red2 – відновник, і:
Ox1 + ne = Red1, | m
Red2 – me = Ox2, |n.
3.Підібрати коефіцієнти для балансу прийнятих та відданих електронів, оскільки основне правило при написанні окисно-відновних реакцій – кількість електронів прийнятих окисником повинна дорівнювати кількості електронів, відданих відновником.
4.Скласти пів реакції з урахуванням коефіцієнтів:
mOx1 + nRed2 = mRed1 + nOx2.
5.Сформулювати умови перебігання реакції. Якщо:
 > 0,4В – умови звичайні.
> 0,4В – умови звичайні.
Якщо різниця потенціалів менша ніж 0,4В, зазвичай треба нагрівання і присутність каталізатору.
Середовище розчину буде видно з сумарного рівняння реакції.
Приклад: скласти рівняння окисно-відновної реакції між редокс парами: MnO4-/Mn2+ і I2/2І-.
1. 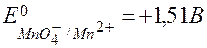 ;
;  . Реакція принципово можлива.
. Реакція принципово можлива.
2.Окисник – іон MnO4-, відновник – іони І-.
3. MnO4- + 8H+ + 5e = Mn2+ + 4H2O | 2
2І- - 2е = І2 | 5
4. 2 MnO4- + 10І- + 16H+ = Mn2+ + 5І2 + 8H2O
5.Оскільки 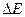 >0,4В, то умови звичайні. Середовище розчину – кисле.
>0,4В, то умови звичайні. Середовище розчину – кисле.
Окисно-відновні реакції широко використовуються в аналітичній хімії. Так при виявлені, наприклад,мангану, іони Mn2+ окислюють до іону MnO4-, який має червоно-малинове забарвлення за допомогою амонію персульфату (NH4)2S2O8:
2MnSO4 + 5(NH4)2S2O8 + 8H2O  2HMnO4 +5(NH4)2SO4 +7H2SO4.
2HMnO4 +5(NH4)2SO4 +7H2SO4.
Також широко ці реакції використовують в кількісному аналізі для визначення окислювання води, купруму, феруму і інших речовин.
Контрольні питання до теми 1.10
10.1.Які реакції звуть окисно-відновними?
10.2.Що таке редокс пара?
10.3.Який потенціал редокс пари звуть стандартним?
10.4.Якм розраховується реальний потенціал редокс пари?
10.5.Як визначити напрямок перебігання окисно-відновної реакції?
10.6.Що таке іонно-електронна пів реакція?
10.7.Як складається рівняння окисно-відновної реакції методом іонно-електронних пів реакцій?
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 637; Нарушение авторских прав?; Мы поможем в написании вашей работы!