
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный показатель, или pH раствора
|
|
|
|
Химически чистая вода является слабым электролитом и весьма незначительная часть ее молекул диссоциирует на ионы:
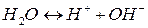
По закону действия масс константа равновесия воды является одновременно константой диссоциации и определяется выражением:
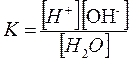 |
Отсюда 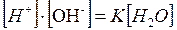
Для температуры 25°С константа диссоциации воды составляет примерно 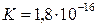 , а
, а  составляет примерно 55,56 моль/л, следовательно:
составляет примерно 55,56 моль/л, следовательно:

Для воды и разбавленных растворов произведение концентрации ионов водорода и гидроксид-анионов является постоянной величиной и называется ионным произведением воды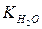 .
.
В чистой воде и нейтральных растворах ври 25°С:
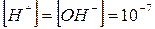 моль/л
моль/л
В кислых растворах больше концентрация ионов водорода, а в щелочных –
концентрация гидроксид-анионов; произведение  остаётся постоянным.
остаётся постоянным.
Кислотные и основные свойства электролитов обычно характеризуются величиной концентрации ионов водорода. Чтобы не использовать числа с отрицательными показателями степени, которыми выражена указанная концентрация, ее принято выражать через водородный показатель, обозначаемый символом рН. Водородный показатель - десятичный логарифм концентрации ионов водорода, взятый с обратным знаком:
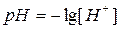
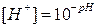
С помощью pH характер среды можно представить следующим образом:
рН = 7 – нейтральная среда; рН < 7 – кислая среда; рН > 7 – щелочная среда.
Для определения реакции среды применяются индикаторы. Индикаторы – это специальные реактивы, изменяющие свою окраску в зависимости от концентрации ионов водорода. Промежуток между двумя значениями рН, в которых изменяется окраска индикатора, называется интервалом перехода окраски индикатора. С помощью универсального индикатора можно дать также приблизительную оценку величины рН раствора. Более точное значение рН определяется с помощью прибора рН -метра.
Величина рН является одной ив важнейших характеристик коррозионных сред и зависит от содержания в воде растворенных газов: 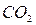 ,
, 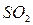 ,
, 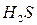 . Во многих случаях она определяет принципиальную возможность протекания коррозионного процесса. При этом имеют место следующие реакции:
. Во многих случаях она определяет принципиальную возможность протекания коррозионного процесса. При этом имеют место следующие реакции:
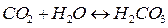
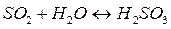
и среда становится кислой (рН<7).
На величину рН оказывают влияние и некоторые соли, которые в воде подвергаются гидролизу.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 702; Нарушение авторских прав?; Мы поможем в написании вашей работы!