
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 4. Окислительно-восстановительные и электрохимические процессы
|
|
|
|
4.1. Электрохимические процессы. Равновесие на границе металл-раствор. Электродный потенциал. Уравнение Нернста. Водородный электрод. Ряд напряжений. Гальванический элемент. Электродвижущая сила.
Основные понятия электрохимии.
Часть химии, изучающая взаимосвязь между химическими и электрическими явлениями. Делиться на две части:
Теоретическая электрохимия
Изучает процесс на границе раздела, металл-электролит.
Прикладная электрохимия
Изучает вопросы:
– Создание химических источников тока.
– Создание водородного топлива.
– Вопросы гальвано пластики.
– Рафинирование металлов.
Особенности окислительно-восстановительных реакции в электрохимической системе.
1. Помимо обычного теплового эффекта, реакция в электрохимической системе сопровождается проявлением электрического тока.
2. Процессы окисления и восстановления в электрохимической системе разделены в пространстве.
3. Передача электронов от восстановителя к окислителю строго направлена.
4. Процессы на границе раздела металл-электролит- равновесные.
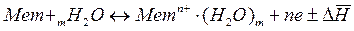
Электрохимические системы
1. Гальванический элемент – это система, в которой в результате ОВР образуется электрический ток.
2. Электролитическая система (электролиз) – это система, в которой
происходят окислительно-восстановительные реакции (ОВР) под действием постоянного тока, приложенного из вне.
Для составления той и другой системы необходимо:
– Электролит
– Электроды
– Проводники 1 рода.
Электролитом может быть раствор, расплав. Электроды – металлы, неметаллы (прессованный уголь).
Электрод, на котором имеет процесс восстановления, называется катодом, а окисления – анодом.
В гальваническом элементе:
Анод – отрицательный электрод, катод – положительный.
Анод – положительный электрод, катод – отрицательный.
Гальванический элемент.
Рассмотрим простой пример. Опустим цинковую пластину в раствор сульфата меди. Через некоторое время цинковая пластина покроется налётом красноватой меди. Прошла обычная окислительно-восстановительная реакция:
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 346; Нарушение авторских прав?; Мы поможем в написании вашей работы!