
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закони Фарадея
|
|
|
|
Кожний іон, що в процесі електролізу нейтралізується на електроді й виділяється на ньому у вигляді нейтрального атома, має визначену масу. Але водночас він переносить через електроліт визначений заряд. Тому і маса речовини, що виділилася, і кількість електрики, що пройшла, пропорційні числу йонів, що підходять до даного електроду.
Розглянемо явище електролізу на прикладі мідного купоросу (складемо коло за схемою рис.1). В результаті електролітичної дисоціації CuSO4 = Cu2+ + SO42-. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді (рис. 2.). Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.


Рис.1. Рис.2.
Нехай за час t через електроліт буде перенесено заряд. Кількість іонів, які досягли електрода, дорівнюватиме:
 , (1)
, (1)
де q0 = Ze - заряд іона; Z - валентність іона; e - елементарний заряд.
Кількість іонів N дорівнює кількості атомів речовини, що виділиться на електроді, а маса виділеної речовини
 , (2)
, (2)
де m0 - маса одного атома, μ - молярна маса речовини.
Для кожного хімічного елемента можна у виразі (2) виділити сталу величину k, яку називають електрохімічним еквівалентом речовини:
 , (3)
, (3)
У СІ електрохімічний еквівалент вимірюють у кілограмах на кулон: [k] = кг/Кл.
Виходячи з цього можна записати, що m = kq = kIΔt (4)
Маса речовини, яка виділяється на катоді за час Δt, пропорційна силі струму і часу. Це твердження, встановлене експериментально Фарадеєм (1831 р.), має назву першого закону Фарадея для електролізу.
Кількісно закон електролізу був установлений дослідним шляхом Майклом Фарадеєм у першій половині XIX сторіччя. Фарадей виявив, що
|
|
|
v маса речовини, яка виділилась на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт.
m = kq
Оскільки q = It, де I — сила струму, t — час проходження і струму, то
т = kІt.
Сталу k називають електрохімічним еквівалентом речовини. Зміст цього коефіцієнта можна з'ясувати з виразу:
v Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики.
Як бачимо, електрохімічні еквіваленти неоднакові не тільки для різних речовин, але й для тієї самої речовини в різних сполуках, у яких вона має різну валентність (наприклад, CuCl і CuS04).
Електрохімічний еквівалент речовини визначено для всіх хімічних елементів. Він є табличною величиною, але його не важко розрахувати:, де  – хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
– хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
F = NAe = 6,02·1023 1/моль ×1,6·10-19 Кл = 96500 Кл/моль.
Стала Фарадея дорівнює заряду, під час перенесення якого одновалентними іонами через розчин або розплав електроліту виділяється 1 моль речовини.
З цих міркувань вираз (4) набуде вигляду:  (5)
(5)
Формула (5) виражає другий закон Фарадея для електролізу: електрохімічні еквіваленти різних речовин прямо пропорційні їх хімічним еквівалентам. Якщо у вираз (4) підставити співвідношення (3), то отримаємо об'єднаний закон Фарадея для електролізу:
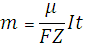
4. Застосування електролізу
Розглянемо найголовніші застосування електролізу в техніці, враховуючи, що в курсі хімії ми вже ознайомилися з використанням електролізу для добування вільного фтору, хлору і інших речовин.
Електрометалургія. На сьогоднішній день багато металів отримують за допомогою електролізу руд. Так, наприклад, алюміній отримують виключно електролізом його розплавленого оксиду (глинозему Al12O3) в кріоліті Na3AlF6. Електролітичною ванною і одночасно катодом служить залізний ящик з вугільним черенем, а анодами є вугільні стержні, які опускаються в розплав. Електроліз проводиться при температурі близько 900 oС, причому висока температура підтримується самим струмом. Розплавлений алюміній опускається на дно ящика, звідки його через спеціальний отвір випускають у форму для виплавки. За допомогою такого електролізу одержують також натрій, магній, берилій, кальцій, фтор і інші речовини.
|
|
|
Очищення металів. В промисловості під час електролізу здійснюють очищення металів. Метал, що очищається, виливають у вигляді пластин і роблять їх анодами в електролітичній ванні. Електролітом є розчин солі даного металу. Підбираючи напругу між анодом і катодом, можна добитися, щоб метал, що очищається, переходив від аноду в розчин і виділявся на катоді. Домішки ж випадають на дно посуду у вигляді осаду. Цей спосіб найбільш поширений для очищення міді, як ми це описали в деталях трохи вище.
Гальванопластика, або електричне осадження металу на поверхні предмету для відновлення його форми здійснюється так: з предмету спочатку знімають зліпок з воску, гіпсу і т.п., покривають його порошком графіту для формування електропровідності і потім використовують зліпок, як катод в електролітичній ванні, яка вміщає розчин солі відповідного металу. Під час електролізу метал з електроліту виділяється на поверхні зліпка і отримують металеву копію предмету. Цим способом виготовляють друкарські кліше, безшовні труби, а також інші металеві деталі складної форми.
Гальваностегія. Електролітичне осадження металів широко використовують для покриття одних металів шаром інших з метою захисту від корозії. Такими є електролітичні позолота, сріблення і т.п.
5. Іонізація газів
Гази, на відміну від металів та електролітів, складаються а електрично нейтральних атомів і молекул і за нормальних умов не містять вільних носіїв струму (електронів і йонів). За звичайних умов гази є діелектриками.
Однак в окремих випадках можна помітно підвищити електропровідність газу. Достатньо, наприклад, піднести полум'я сірника до зарядженого електроскопа, як він відразу ж розряджається. З цього досліду доводить висновок, що під дією полум'я повітря втрачає свої ізоляційні властивості, тобто в ньому з'являються вільні заряди. Повітря, як і інші гази, можна зробити електропровідним, діючи на нього ультрафіолетовим, рентгенівським і радіоактивним випромінюванням.
|
|
|
Для відривання електрона від атома необхідна визначена енергія, що називається енергією йонізації.
v Іонізація газів — відривання від їхніх атомів чи молекул електронів.
Протилежним процесу йонізації газів є процес рекомбінації — возз'єднання протилежно заряджених частинок у нейтральні молекули.
Іонізатор щомиті створює в просторі між електродами певне число йонів і електронів. Стільки ж іонів і електронів, з'єднуючись між собою, утворюють нейтральні атоми. Така динамічна рівновага існує доти, поки між електродами немає електричного поля. Як тільки між електродами буде створене поле, відразу ж на частинки, що несуть заряди різного знака, почнуть діяти сили, спрямовані в протилежні боки. Тому, нарівні з безладним рухом, заряджені; частинки будуть переміщатися в напрямку дії на них електричного поля. Це спрямований рух частинок під дією електричного поля й являє собою струм у газі.
v Процес протікання електричного струму через газ називають газовим розрядом.
6. Несамостійний і самостійний розряди
Іонізація газу може відбуватися під впливом різних зовнішніх впливів (сильне нагрівання газу, рентгенівське чи радіоактивне випромінювання, космічне випромінювання, бомбардування електронами або йонами, що швидко рухаються), що називаються зовнішніми йонізаторами.
Існує 2 види газового розряду: несамостійний і самостійний. Якщо електропровідність газу виникає під дією іонізаторів, а з видаленням останнього зникає, то має місце несамостійний розряд.
Газовий розряд, який можна спостерігати тільки за наявності зовнішнього іонізатора, називають несамостійним газовим розрядом.
За певних умов струм у газах може проходити і без зовнішнього іонізатора.
Газовий розряд, що продовжується після того, як припиняється дія зовнішнього іонізатора, називають самостійним газовим розрядом.
|
|
|
Яка ж причина появи носіїв заряду в цьому випадку?
Електричне поле діє на заряджені частинки, що знаходяться в газі (електрони й іони). Якщо поле достатньо сильне, то електрони розганяються полем до такої швидкості, що внаслідок зіткнень з атомами чи молекулами, відбувається їхня іонізація.
Внаслідок іонізації з'являються нові заряджені частинки — іони й електрони Вони так само розганяються полем, електрони іонізують нові атоми чи молекули, що, у свою чергу, створює додаткове збільшення кількості заряджених частинок.
У результаті кількість заряджених частинок різко зростає — це явище одержало назву електронної лавини. Саме нею і пояснюється самостійний розряд у газах.
7. Іонізація електронним ударом
Отже, вільний електрон, що з'явився завдяки дії зовнішнього іонізатора, починає рухатися до анода, а позитивний йон — до катода. У проміжках між двома послідовними зіткненнями енергія електрона збільшується за рахунок роботи сил електричного поля.
Щоб електрон зміг під час зіткнення вибити електрон з нейтрального атома, він повинен набрати достатню швидкість. Досягти значної швидкості електрон може у двох випадках: якщо розганятися або довго, або сильно.
За атмосферного тиску електрон зазнає багатьох зіткнень, тому поле, у якому він рухається, має бути дуже сильним, щоб електрон устиг набути необхідної швидкості за короткий проміжок часу між зіткненнями. Наприклад, самостійний газовий розряд в атмосфері — блискавка — виникає за напруги в сотні тисяч вольт.
Якщо кінетична енергія електрона перевищує роботу, яку треба виконати, щоб іонізувати нейтральний атом, тобто
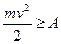
то під час зіткнення електрона з атомом відбувається йонізація. У результаті замість одного вільного електрона з'являються два. Ці електрони, у свою чергу, одержавши енергію в полі, іонізують зустрічні атоми тощо. Унаслідок цього число заряджених частинок різко зростає, виникає електронна лавина.
У газах за великих напруженостей електричних полів електрони досягають таких великих енергій, що починається йонізація
електронним ударом. Розряд стає самостійним і продовжується без зовнішнього іонізатора.

|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 3105; Нарушение авторских прав?; Мы поможем в написании вашей работы!