
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислородные соединения серы
|
|
|
|
Свойства соединений серы(IV).
Оксид серы(IV) SO2 (сернистый газ) – это бесцветный газ, с резким запахом, тяжелее воздуха. при температуре -10оС сгущается в бесцветную жидкость. Диоксид серы менее токсичен, чем сероводород, хорошо растворим в воде (40 объемов в 1 объеме воды). Молекула SO2 имеет угловое строение, связи в молекуле располагаются под углом 120о друг к другу. Связь сера – кислород – полярная связь, молекула SO2 тоже полярна. Длина связи S – О равна 0,143 нм. В промышленности SO2 получают:
а) сжиганием серы в специальных печах:
S + О2 = SO2
б) при обжиге сернистых металлов:
4 FeS2 + 11 О2 = 8 SO2 + 2 Fe2О3
Сера входит в состав многих твердых горючих ископаемых и при их сжигании выделяется большое количество сернистого газа, загрязняющего атмосферу.
В лаборатории диоксид серы получают действием разбавленной серной кислоты на сульфиты:
Na2SО3 + Н2 SО4 (разб.) = Na2SО4 + Н2SО3;
Н2SО3 = SO2↑+ Н2О
или действием концентрированной серной кислоты на медь:
Cu + 2 Н2 SО4 (конц.) = CuSО4 + SO2↑+ Н2О
Оксид серы(IV) химически активное вещество, в окислительновосстановительных реакциях может проявлять двойственные свойства. При пропускании SO2 через сероводородную воду выделяется сера:
SO2 + 2 H2S = 3 S + 2 H2O
Однако для оксида серы(IV) более характерны восстановительные свойства:
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
SO2 + Br2 + 2H2O = H2SO4 + 2 НВr
В пищевой промышленности SO2 используют для продувки через сок сахарной свеклы (сульфитизация) для его обесцвечивания, обеззараживания и снижения щелочности. В процессах консервирования пюре, соков, плодов он играет роль антисептика, консерванта и антиокислителя. После удаления SO2 (десульфитизация) остаточное содержание диоксида серы в продуктах не должно превышать 0,01 %. Наличие неподеленной электронной пары у атома серы придает молекуле SO2 способность к реакциям присоединения. На прямом солнечном свету SO2 соединяется с хлором, образуя хлористый сульфурил:
SO2 + С12 = SO2С12
SO2С12 – бесцветная жидкость с резким запахом, является хлорангидридом серной кислоты, легко гидролизуется:
SO2С12 + 2H2O = H2SO4 + 2 НС1
Способность SO2 к реакциям присоединения и его окислительные свойства позволяет использовать диоксид серы для отбелки шерсти, шелка, соломы, для осветления дубильных экстрактов. Однако со временем бесцветные соединения SO2 с окрашивающими материал примесями разрушаются, и материал приобретает свой прежний цвет.
С кислородом диоксид серы взаимодействует с заметной скоростью только в присутствии катализатора (Pt, V2О5 и другие):
2 SO2 + О2 = 2 SO3
Оксид серы(IV) проявляет свойства кислотного оксида, при растворении в воде, взаимодействует с ней, образуя, сернистую кислоту:
SO2 + Н2О = Н2SО3.
При сжигании угля, содержащего небольшие количества соединений серы, в атмосферу выбрасывается диоксид серы. Растворяясь во влаге, находящейся на листьях или в воздухе, SO2 образует раствор сернистой кислоты, который затем окисляется до серной кислоты. Атмосферная влага с растворенными SO2 и H2SO4 выпадает в виде кислотных дождей, приводящих к гибели растительности.
Свойства сернистой кислоты. Раствор SO2 в воде называется сернистой кислотой. Н2SО3 неустойчивая кислота, существует только в растворах:
Н2SО3 ↔ SO2↑+ Н2О
При нагревании равновесие смещается в сторону прямой реакции и можно полностью удалить диоксид серы из раствора. Сернистая кислота является кислотой средней силы. Она двухосновна:
Н2SО3 ↔ Н+ + НSО3- (Кд = 2.10-2)
НSО3- ↔ Н+ + SО32- (Кд = 6.10-8)
Н2SО3 – образует средние соли Na2SО3 (сульфиты) и кислые соли NaНSО3 (гидросульфиты). Сульфиты большинства металлов нерастворимы в воде (кроме щелочных металлов и аммония). Соли подвергаются гидролизу:
Na2SО3 + H2O ↔ NaHSО3 + NaOH
Все сульфиты и гидросульфиты разлагаются кислотами:
Na2SО3 + 2 НС1 = 2 NaС1 + Н2SО3
Н2SО3 = SO2↑+ Н2О
При нагревании сульфиты диспропорционируют:
4 Na2SО3 = 3 Na2SО4 + Na2S
Сернистая кислота и ее соли обладают окислительно-восстановительной
двойственностью:
So ← S+4O2 → S+6O42-
5Na2SО3 + 2КМnО4 + 8Н2SО4 = 5Na2SО4 + 2МnSО4 + К2SО4 + 8H2O
Na2SО3 + С12 + H2O = Na2SО4 + 2 НС1
SО32- + 4Н+ + 4 ē = S + 2 H2O, Е° = 0,45
SО32- + 2 ОН- - 2 ē = SО42- + H2O, Е° = -0,93 В
Восстановительные свойства для производных серы со степенью окисления +4 (диоксид, сернистая кислота и ее соли) более характерны, чем окислительные свойства. Практически мгновенно протекает окисление сульфитов и гидросульфитов многими окислителями (КМnО4, С12, Вr2 и т.д.) На этом основано использование NaНSО3 в качестве антихлора. Сульфит-ион открывают с помощью раствора йода, при этом раствор йода обесцвечивается.
I2 + Na 2SО3 + Н2О = 2 НI + Na2SO4
Сульфиты настолько сильные восстановители, что даже в твердом виде они постепенно окисляются кислородом воздуха:
2 Na2SО3 + О2 = 2 Na2SО4
Сульфиты легко присоединяют не только кислород, но и серу:
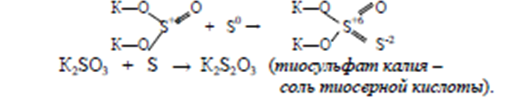
Н2S2О3 – тиосерная кислота. По силе эта кислота близка к серной кислоте, но в свободном состоянии неустойчива и разлагается:
К2S2О3 + Н2SО4 = К2SО4 + Н2S2О3
Н2S2О3 = SО2↑ + S↓ + Н2О
Соли тиосерной кислоты (известны только средние соли) довольно устойчивы, бесцветны и хорошо растворимы в воде. Свойства этих солей обуславливаются присутствием атомов серы в различных степенях окисления. Наличие S-2 придает им восстановительные свойства. Тиосульфат натрия (гипосульфит) имеет наибольшее практическое значение. Na2S2О3 используется для связывания хлора:
Na 2S2О3 + С12 (недостаток) + Н2О = Na2SО4 + S + 2 НС1
Na 2S2О3 + 4 С12 (избыток) + 5 Н2О = Na2SО4 + Н2SО4 + 8 НС1
Na 2S2О3 используется в медицине как противотоксичекое средство при отравлениях соединениями ртути, свинца, синильной кислотой и ее солями, при этом образуются плохо растворимые нетоксичные сульфиты или менее ядовитые тиоцианаты:
S2О3 2- = SО32- + S;
Pb2+ + SО32- = PbSО3↓
S + СN- = NСS -
В фотографии Na 2S2О3 (фиксанажная соль) используется для удаления
неразложившегося бромида серебра.
2 Na 2S2О3 + AgBr = NaBr + Na3[Ag(S2О3)2]
Важным свойством тиосульфата натрия является его способность образовывать с иодом бесцветный тетратионат нария:
I2 + 2Na 2S2О3 = 2NaI + Na2S4O6 (Соль тетратионовой кислоты)
Эта реакция широко используется в аналитической химии (в объемном анализе).
Политионовые кислоты – это кислоты состава: Н2SхО6 или Н2(О3S–Sх–SО3), где х = 0-16, В состав политионовых кислот входят зигзагообразные цепи атомов серы. Название кислоты и ее солей определяется числом атомов серы, входящих в состав кислоты или соли:
Na2S6O6 - гексатионат; Na2S5O6 - пентатионат; Na2S4O6 – тетратионат; Na2S2O6 - дитионат. Политионовые кислоты существуют только в водных растворах и медленно разлагаются при хранении:
Н2SхО6 = Н2SО4 + SО2 + (х-2)S
Соли политионовых кислот щелочных металлов хорошо растворимы в воде. В сухом состоянии довольно устойчивы, при нагревании они разлагаются: Na2S6O6 = Na2SО4 + SО2 + 4 S↓
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 12035; Нарушение авторских прав?; Мы поможем в написании вашей работы!