
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В идеальном газе
|
|
|
|
Во многих теплотехнических установках происходят различные процессы с веществами, находящимися в газовой фазе. Это относится к двигателям внутреннего сгорания, компрессорам, соплам, горелкам и т.п. При этом в большинстве случаев эти газы или газовые смеси можно считать идеальными. То есть уравнение состояния для них имеет вид (см. раздел 2):
 . (14.1)
. (14.1)
Для разработки технических решений по совершенствованию подобного оборудования необходимо уметь рассчитывать протекающие в нём процессы.
В этом параграфе на уровне постановки общей задачи рассматривается, каким образом рассчитываются термодинамические процессы в идеальном газе.
Любая физико-математическая модель какого-то технологического процесса строится в два этапа. Вначале описывается физическая модель, в которой определяются искомые функции. Затем составляется замкнутая система уравнений, позволяющая однозначно определить искомые функции.
Будем считать, что в идеальном газе происходит некий произвольный равновесный (обратимый) процесс. Пусть р, Па, υ, м3/кг, и Т, К – параметры состояния газа (абсолютное давление, удельный объём и абсолютная температура соответственно). Тогда, как известно, в р υ -координатах данный процесс может быть представлен непрерывной линией р = f (υ), приведённой на рис. 14.1. Функция f (υ) называется уравнением процесса. Это непрерывная функция удельного объёма, соединяющая точки 1 и 2 – начала и конца процесса. В различных процессах f (υ) имеет свой вид. Например, в процессе при постоянном удельном объёме это вертикальная линия, а в процессе при постоянном давлении – горизонтальная линия.
Очевидно, что в общем случае в ходе процесса 1 – 2 непрерывно изменяются все параметры состояния системы (идеального газа) р, υ, Т, а также все удельные функции состояния: внутренняя энергия u, Дж/кг; энтальпия i, Дж/кг; энтропия s, Дж/(кг · К).
Основной целью построение математической модели является обретение возможности рассчитывать для конкретного случая удельные теплоту q и работу l процесса, а также значения параметров состояния в любой точке процесса.

Рис. 14.1. Изображение некоего равновесного процесса в р υ -координатах
Аналитическим основанием математической модели, описывающей процесс 1 – 2 (рис. 14.1), являются следующие четыре положения термодинамики.
Первый закон термодинамики в дифференциальной форме (см. раздел….):
du = dq – dl, (14.2)
где du, dq и dl – дифференциалы (бесконечно малые приращения) удельной внутренней энергии, удельной теплоты и удельной работы процесса, Дж/кг.
Определение истинной удельной теплоёмкости для произвольного процесса (см. раздел….):
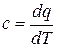 или dq = с · dТ, (14.3)
или dq = с · dТ, (14.3)
где с = с (Т, f (υ)) – истинная удельная теплоёмкость системы, зависящая в рассматриваемом общем случае не только от температуры Т, но и от вида функции уравнения процесса f (υ), Дж/(кг · К).
Общее выражение для расчёта механической работы расширения системы в ходе любого равновесного процесса, которая также зависит от вида функции f (υ) (см. раздел…….):
dl = р dυ = f (υ) · dυ. (14.4)
Определение удельной энтропии системы:
 или dq = Т · ds, (14.5)
или dq = Т · ds, (14.5)
где ds – дифференциал удельной энтропии системы, Дж/(кг · К).
Вместе выражения (14.2) …. (14.5) образуют систему из четырёх дифференциальных уравнений:
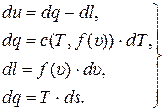 (14.6)
(14.6)
Замечание:
Записанная в общем виде система уравнений (14.6) может быть использована для анализа процессов, происходящих в любых системах: идеальных газах; реальных газах; системах, находящихся в жидкой и твёрдой фазе.
Систему (14.6) можно рассматривать как систему дифференциальных уравнений с пятью неизвестными искомыми функциями u, q, l, s и с, аргументами которых являются параметры состояния р, υ, Т. Для наглядности можно сказать, что р, υ, и Т выполняют здесь роль подобную той, которую часто выполняют привычные в математике переменные x, y и z – декартовы координаты. Отличие заключается в том, что координаты x, y и z в математике, как правило, рассматриваются как независимые переменные, тогда как р, υ, и Т не являются независимыми переменными, а всегда связана между собой, например, для идеального газа уравнением состояния (14.1).
В силу (14.1) независимыми из трёх переменных величин р, υ, и Т могут быть только любые два, а третья однозначно определяется по их значениям из уравнения (14.1). Таким образом искомые в (14.6) функции могут рассматриваться, как функции двух независимых аргументов – любых двух из трёх параметров состояния р, υ, и Т. При этом заранее известно, что функции состояния u и s зависят только от параметров состояния и не зависят от уравнения процесса (вида функции f (υ)), тогда как остальные три искомые функции q, l и c зависят и от параметров состояния и от вида функции f (υ).
Так как в системе (14.6) число искомых функций больше числа уравнений, то для её однозначного разрешения требуется добавить в качестве пятого независимого уравнения какие-то дополнительные условия, которые с одной стороны, накладывают какие-то дополнительные ограничения на характер рассматриваемого процесса 1 – 2, а с другой стороны, позволяет однозначно разрешить систему (14.6).
Понятно, что это дополнительное условие должно также способствовать решению актуальных технических поблеем. Именно такими дополнительными условиями являются широко известные условия, характеризующие следующие термодинамические процессы, происходящие в газах и газовых смесях:
• при постоянном удельном объёме – изохорный (от греческих изос – одинаковый, хорос – место);
• при постоянном давлении – изобарный (аналогично, бар – сила);
• при постоянной температуре – изотермический;
• без подвода к системе и отвода от неё энергии в форме теплоты – адиабатный (от греческого адиабатос – непереходимый, т.е. система как бы окружена непроходимой для теплоты оболочкой);
• процесс, в котором параметры состояния связаны между собой соотношением
р υn = const, (14.8)
где n – постоянная величина, которая может принимать значение в интервале от –∞ до +∞.
Такой процесс называется политропным, а n – показатель политропы. (Термин образован из греческих слов поли – много, тропос – тропа, путь. То есть политропный – это многотропиночный, многопутный.)
Первые четыре процесса называются основными термодинамическими процессами. Политропный процесс является обобщающим в том смысле, что все основные процессы являются частными случаями политропного процесса (подробнее см. ниже).
Для однозначного разрешения системы (14.6) помимо перечисленных выше дополнительных условий требуется задать необходимые условия однозначности, позволяющие определить значения у появляющихся в результате интегрирования констант интегрирования. Это могут быть, значения начальных и конечных температур, давлений и т.п.
В следующих разделах будет показано как решается (интегрируется) система (14.6) для перечисленных выше процессов.
15. Расчёт процессов в идеальном газе
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 415; Нарушение авторских прав?; Мы поможем в написании вашей работы!