
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Авогадро
|
|
|
|
Закон Авогадро был открыт экспериментальным путём в 1811 году и напрямую с числом Авогадро не связан. Формулируется он следующим образом.
При одинаковых давлениях и одинаковых температурах в равных объёмах различных идеальных газов содержится одинаковое число молекул, или, что тоже самое, при одинаковых давлениях и одинаковых температурах моль различных идеальных газов занимает одинаковый объём.
Опытным путём установлено, что при нормальных условиях (н.у. Т о = 273,15 К и р о = 1 атм = 101325 Па) один киломоль любого идеального газа занимает объём 22,4136 ≈ 22,4 м3. Соответственно один моль будет занимать объём V o = 22,4 · 10–3 м3.
Этот факт можно рассматривать, как следствие из закона Авогадро для н.у.
2.4. Уравнение Клапейрона – Менделеева
Как уже отмечалось (п. 2.1 данного приложения), путём обобщения экспериментальных данных было получено уравнение состояния идеального газа (1). Учитывая определение удельного объёма его можно переписать в виде:
 или р V = M R T, (8)
или р V = M R T, (8)
где V – объём газа, м3; M – масса газа, кг.
Соотношение (8) справедливо всегда, в частности, оно будет выполняться для одного киломоля некоторого идеального газа, находящегося при нормальных условиях. Для такого случая, исходя из (8), можно записать:
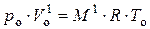 , (9)
, (9)
где р о и Т о – нормальные давление и температура соответственно
р о = 101325 Па, Т о = 273,15 К; 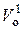 – объём, который занимает один киломоль идеального газа при н.у.
– объём, который занимает один киломоль идеального газа при н.у. 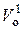 = 22,4 м3; М1 – масса одного киломоля газа, кг.
= 22,4 м3; М1 – масса одного киломоля газа, кг.
Значение массы одного киломоля (103 молей) газа определяется по (2) (см. п. 2.2) следующим образом:
М 1 = μ · 1 · 103, (10)
где μ – молярная масса газа, кг/моль.
Подставляя (10) в (9) получаем:
 или
или 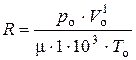 . (11)
. (11)
Подставляя в (11) известные численные значения для р о, 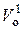 и Т о, получаем:
и Т о, получаем:
 , Дж/(кг · К). (12)
, Дж/(кг · К). (12)
Размерность у числа 8,314, стоящего в числителе (12) Дж/(моль · К). Это число обозначается буквой R μ, Дж/(моль · К), и называется универсальной газовой постоянной.
С учётом такого обозначения вместо (12) можно записать:
 , Дж/(кг · К). (13)
, Дж/(кг · К). (13)
Формула (13) позволяет определить значение газовой постоянной R для любого газа или газовой смеси, не прибегая к экспериментам, так как μ всегда известна.
Подставляя (13) в (1) окончательно получаем уравнение состояния идеального газа в виде формулы Менделеева – Клапейрона
 . (14)
. (14)
Приложение 3
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 365; Нарушение авторских прав?; Мы поможем в написании вашей работы!