
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие моль вещества
|
|
|
|
Рассмотрим некоторую однородную систему, состоящую из конечного числа одинаковых структурных элементов, например, атомов, молекул, песчинок, «кирпичиков» и т.п. Количественно охарактеризовать такую систему можно тремя различными способами.
Проиллюстрируем эти три физические характеристики системы на одном гастрономическом примере – некотором количестве красной икры. Для наглядности будем считать, что: икра фасуется в стандартные баночки – по 120 г икры в каждую; вся икра состоит из одинаковых икринок; масса одной икринки 0,1 г.
Теперь, если кто-то приглашает нас «на баночку икры», то сразу понятно, что речь идёт о 120 граммах или о 1200 штуках (единицах) икринок. То есть одно и то же количество икры можно охарактеризовать тремя разными способами:
• по массе – 120 г;
• по единицам – 1200 штук (единиц структурных элементов);
• по банкам – 1 банка.
При этом в одних случаях удобнее оперировать граммами, в других – банками.
Так вот, когда речь идёт о молях, то по сути речь идёт о «банках» – о третьем способе определения количества вещества, состоящего из одинаковых структурных элементов. Только в «банке», которая называется молем, должно быть не 1200, а 6,02 · 1023 штук (единиц) икринок. Число
6,02 · 1023 получено экспериментальным путём на базе определения, которое в системе СИ даётся одному молю, как единице количества вещества, то есть моль любого вещества – это всегда 6,02 · 1023 единиц структурных элементов.
В соответствии с резолюцией №3 14-ой Конференции по мерам и весам (1971 г.) по определению в одном моле содержится столько единиц структурных элементов вещества, сколько атомов содержится в 12 граммах углерода 12С – углерода с атомной массой 12 а.е.м. (атомных единиц массы).
Как уже отмечалось, с помощью специальных экспериментов определено, что в 12 граммах углерода 12С содержится примерно 6,02 · 1023 штук (единиц) атомов. (Соответственно в 12 кг – 6,02 · 1026 единиц).
В физике вводится число Авогадро N A = 6,02 · 1023 (1/моль), которое равно числу единиц структурных элементов любого вещества в одном моле.
Так как массы молекул (структурных элементов) у различных веществ, как правило, различны, то и масса 6,02 · 1023 единиц таких различных молекул будут разными. Другими словами – масса одного моля для каждого вещества имеет своё значение. Например, для углерода 12С это 12 · 10–3 кг, что следует непосредственно из определения моля.
По определению масса одного моля вещества называется его молярной массой.
Из этого определения следует, что масса вещества М, кг, и число молей этого вещества N, моль, связаны очевидным соотношением:
М = μ W · N, (2)
где μ W – молярная масса некоторого вещества, кг/моль.
Следует отметить, что молярная масса μ W любого вещества в расчётах является известной величиной. Следовательно, по (2) М и N всегда легко пересчитываются друг в друга.
Покажем, что молярная масса легко вычисляется по известной молекулярной массе этого вещества, выраженной в атомных единицах массы, то есть определённой по таблице Менделеева.
Из определения молярной массы для любого вещества можем записать:
μ W = 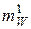 · N A, (3)
· N A, (3)
где μ W – молярная масса вещества, кг/моль;  – масса одного структурного элемента (атома или молекулы) рассматриваемого вещества, кг; N A – число Авогадро, 1/моль.
– масса одного структурного элемента (атома или молекулы) рассматриваемого вещества, кг; N A – число Авогадро, 1/моль.
В частности, для углерода 12С из (3) получим:
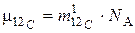 , (4)
, (4)
где 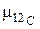 – молярная масса углерода 12С, которая по определению равна 12 · 10–3, кг/моль;
– молярная масса углерода 12С, которая по определению равна 12 · 10–3, кг/моль; 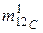 – масса одного атома углерода 12С, кг.
– масса одного атома углерода 12С, кг.
После деления обоих частей равенств (3) и (4) друг на друга получаем:
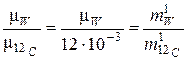 . (5)
. (5)
Очевидно, что отношение масс структурных элементов, стоящее в правой части (5), не изменится, если эти массы будут определены не в килограммах, а в атомных единицах массы (а.е.). Учитывая, что один атом углерода 12С имеет массу равную 12 а.е. можем записать:
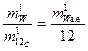 , (6)
, (6)
где 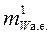 – масса атома или молекулы вещества в атомных единицах массы, а.е.
– масса атома или молекулы вещества в атомных единицах массы, а.е.
Значение 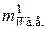 , как известно, для любого вещества рассчитывается по его химической формуле. Например, молекулярная масса Н2О равна 18 а.е.
, как известно, для любого вещества рассчитывается по его химической формуле. Например, молекулярная масса Н2О равна 18 а.е.
Подставляя (6) в (5) получаем:
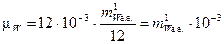 , кг/моль. (7)
, кг/моль. (7)
Из (7) следует, что молярная масса любого вещества численно равна его молекулярной массе, выраженной в атомных единицах массы, умноженной на 10 –3. (При этом очевидно, что масса одного киломоля вещества численно равна его молекулярной массе).
Примечание:
1. Из (7) следует, что молекулярную массу любого вещества μ W легко можно вычислить по таблице Менделеева.
2. При выполнении количественных расчётов по стехиометрическим уравнениям химических реакций удобно пользоватьcя молярными массами и числом молей.
Без понятия моль в таких расчётах пришлось бы постоянно переводить молекулярную массу различных веществ из атомных единиц массы в килограммы, что достаточно неудобно (1 а.е.м. = 1,660538782 · 10 –27 кг).
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 712; Нарушение авторских прав?; Мы поможем в написании вашей работы!