
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы молекулярно-кинетической теории
|
|
|
|
Идея об атомарном строении вещества (атомистика) была высказана древнегреческим философом Демокритом (460-370 г.до н.э.). Затем она была забыта на долгие годы и вновь возродилась лишь в XVII в., получив развитие в работах М.В. Ломоносова, взгляды которого на строение вещества близки к современным. Строгое развитие молекулярной теории и формулировка основных положений молекулярно-кинетической теории (МКТ) относится к середине XIX в. (работы Р. Клаузиуса, Дж. Максвелла и Л. Больцмана). Основные положения МКТ следующие:
1. Все тела состоят из большого числа атомов и молекул. Массы атомов и молекул неорганических веществ составляют величины порядка 10-26 кг , размер атомов и неорганических молекул – величины порядка 10-10 м (1 Å). Органические молекулы могут состоять из сотен атомов и имеют значительно большие, по сравнению с неорганическими молекулами, размеры и массы.
В качестве единицы количества вещества используется моль – количество вещества, которое содержит столько же частиц (атомов, молекул), сколько атомов содержится в 12 граммах углерода. Было установлено, что в 12 граммах углерода содержится 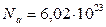 атомов. Это число называется числом Авогадро. Таким образом, моль любого вещества содержит
атомов. Это число называется числом Авогадро. Таким образом, моль любого вещества содержит 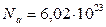 атомов или молекул. Размерность числа Авогадро – моль-1.
атомов или молекул. Размерность числа Авогадро – моль-1.
Масса одного моля вещества 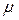 называется молярной массой. Молярная масса связана с массой одной молекулы
называется молярной массой. Молярная масса связана с массой одной молекулы 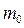 соотношением
соотношением 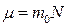 и измеряется в
и измеряется в 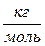 .
.
Если  масса всего вещества, то количество вещества
масса всего вещества, то количество вещества  (в молях) равно
(в молях) равно 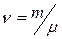 . Расстояние между молекулами в веществе l можно оценить, зная плотность вещества
. Расстояние между молекулами в веществе l можно оценить, зная плотность вещества 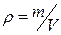 (массу единицы объема) и молярную массу
(массу единицы объема) и молярную массу 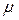 . Концентрация
. Концентрация 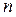
(число частиц в единице объема) связана с плотностью, молярной массой и числом Авогадро соотношением:
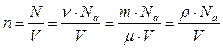 , (7.3.1)
, (7.3.1)
где 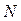 - число частиц, содержащихся в веществе массой
- число частиц, содержащихся в веществе массой 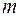 ;
; 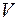 - объем вещества. Величина, обратная концентрации, есть объем
- объем вещества. Величина, обратная концентрации, есть объем 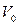 , приходящийся на одну частицу.
, приходящийся на одну частицу.
Расстояние между частицами  . (7.3.2)
. (7.3.2)
Для жидкостей и твердых тел плотность слабо зависит от температуры и дав
ления, поэтому l является практически постоянной величиной порядка 10-10 м и
сопоставима с размерами самих молекул.
Плотность газа сильно зависит от давления и температуры. При нормальных условиях (НУ) – давлении 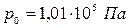 , температуре
, температуре 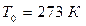 – оценка
– оценка  дает значение 10-9–10-8 м . Таким образом, в газах расстояние между молекулами гораздо больше размеров самих молекул.
дает значение 10-9–10-8 м . Таким образом, в газах расстояние между молекулами гораздо больше размеров самих молекул.

Пример 7.3.1. Найти число атомов 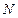 и их концентрацию
и их концентрацию 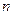 в золотой монетке массой
в золотой монетке массой  . Оценить массу
. Оценить массу 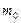 и размер
и размер 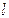 атома золота. Плотность золота
атома золота. Плотность золота  .
.
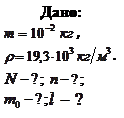
 Решение:
Решение:
 Число атомов золота найдем по формуле 7.3.1:
Число атомов золота найдем по формуле 7.3.1: 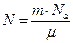 , где
, где 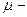 молярная масса золота, которую определим по таблице Менделеева
молярная масса золота, которую определим по таблице Менделеева 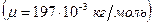 .
. 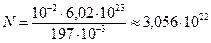 .
.
Концентрация 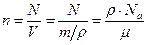 ,
, 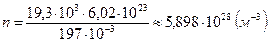 . Поскольку в твердых телах атомы плотно примыкают друг к другу, размер атома
. Поскольку в твердых телах атомы плотно примыкают друг к другу, размер атома  примерно равен расстоянию между атомами:
примерно равен расстоянию между атомами: 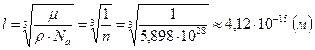 .
.
Массу одной молекулы золота найдем делением его молярной массы на постоянную Авогадро: 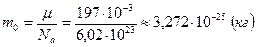 .
.
 Ответ:
Ответ: 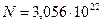 ,
, 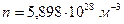 ,
, 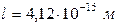 ,
, 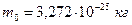 .
.
2. Молекулы находятся в состоянии непрерывного теплового (скорость движения молекул определяется температурой) хаотического движения.
Движение и взаимодействие молекул подчиняется законам квантовой механики, но для широкого класса задач оказывается применимым классический подход, когда поведение молекул определяется законами классической механики Ньютона.
Двигаясь хаотически, молекулы непрерывно сталкиваются друг с другом. Путь, проходимый молекулой между двумя последовательными столкновениями, называется длиной свободного пробега  . Так как молекулы движутся хаотически, имеет смысл говорить о средней длине свободного пробега
. Так как молекулы движутся хаотически, имеет смысл говорить о средней длине свободного пробега 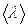 .
.
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы 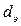 (он зависит от скорости столкновения молекул, т.е. от температуры газа).
(он зависит от скорости столкновения молекул, т.е. от температуры газа).
 Так как за 1 с молекула проходит путь, равный средней скорости
Так как за 1 с молекула проходит путь, равный средней скорости 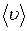 , то
, то
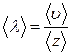 , (7.3.3)
, (7.3.3)
где 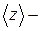 среднее число столкновений, испытываемых молекулой газа за 1 с.
среднее число столкновений, испытываемых молекулой газа за 1 с.
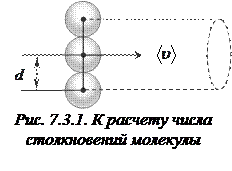
Для определения 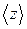 представим молекулу в виде шарика диаметром
представим молекулу в виде шарика диаметром 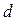 . Эта молекула столкнется только с теми молекулами, центры которых будут находиться на расстояниях, равных или меньших
. Эта молекула столкнется только с теми молекулами, центры которых будут находиться на расстояниях, равных или меньших 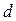 , т.е. лежат внутри цилиндра радиусом
, т.е. лежат внутри цилиндра радиусом 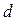 (рис. 7.3.1).
(рис. 7.3.1).
Среднее число столкновений за 1 с равно числу молекул в объеме цилиндра: 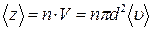 , где
, где  концентрация молекул.
концентрация молекул.
Расчеты показывают, что для учета движения других молекул необходимо ввести множитель 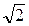 :
:
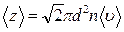 . (7.3.4)
. (7.3.4)
Тогда средняя длина свободного пробега равна
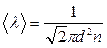 , (7.3.5)
, (7.3.5)
т.е. обратно пропорциональна концентрации. Величину  называют площадью эффективного сечения молекул. Таким образом,
называют площадью эффективного сечения молекул. Таким образом, 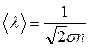 .
.
Среднее время свободного пробега 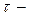 время между двумя последовательными столкновениями - зависит от средней скорости молекул и длины свободного пробега:
время между двумя последовательными столкновениями - зависит от средней скорости молекул и длины свободного пробега:
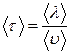 . (7.3.6)
. (7.3.6)
Формулы, определяющие зависимость 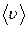 от температуры газа, приводятся в параграфе 8.2.
от температуры газа, приводятся в параграфе 8.2.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 609; Нарушение авторских прав?; Мы поможем в написании вашей работы!