
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Ван-дер-Ваальса
|
|
|
|
В модели идеального газа не учитывались ни взаимодействия молекул, ни конечный размер самих молекул. Попытаемся учесть приближенно эти два обстоятельства. Для простоты рассмотрим 1 моль газа. Для него уравнение состояния идеального газа имеет вид:
 . (3.9.1)
. (3.9.1)
1. Учтем конечные собственные размеры молекул. Это приводит к тому, что объём, предоставленный молекулам газа для движения, будет меньше объёма сосуда V. Для этого заменим в уравнении (3.9.1) объём сосуда V на объём V – b, где b – характерная для данного газа положительная постоянная, учитывающая занимаемый молекулами объём.
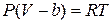 ,
, 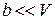 . (3.9.2)
. (3.9.2)
2. Учтем проявляющееся на больших расстояниях притяжение между молекулами. Притяжение должно приводить к уменьшению давления газа на стенки сосуда, т.к. на каждую молекулу, находящуюся вблизи стенки сосуда, будет действовать со стороны других молекул сила, направленная внутрь сосуда. Поэтому уравнение (3.9.2) следует уточнить.
 . (3.9.3)
. (3.9.3)
Оценим поправку D P. На некоторую молекулу A, взаимодействующую со стенкой сосуда, действует сила со стороны остальных молекул, направленная внутрь сосуда. Эта сила, пропорциональна числу окружающих молекулу A молекул, т.е. пропорциональна плотности газа. Таким образом, поправка к передаваемому молекулой A импульсу при ударе о стенку пропорциональна плотности газа. Величина DP в формуле (3.9.3) будет пропорциональна переданному всеми молекулами импульсу, т.е. будет пропорциональна квадрату плотности газа, или обратно пропорциональна квадрату объёма:
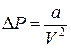 , (3.9.4)
, (3.9.4)
где a – характерная для данного газа положительная постоянная. При этом
 .
.
В результате получим следующее уравнение состояния 1 моля газа:
 . (уравнение Ван-дер-Ваальса) (3.9.5)
. (уравнение Ван-дер-Ваальса) (3.9.5)
Исследуем зависимость P (V) при фиксированных значениях постоянных a и b для различных значений температуры T и построим графики этих зависимостей в координатах PV. Полученные кривые, называемые изотермами Ван-дер-Ваальса, приведены на рис. 3.9.1.
Как видно из этого рисунка для достаточно высокой температуры T 1 изотерма Ван-дер-Ваальса мало отличается от изотермы идеального газа. При более низких температурах T 2 и T 3 изотермы содержат волнообразный участок. Существует некоторая температура Tк такая, что соответствующая ей изотерма отделяет все монотонные изотермы, лежащие выше нее, от «горбатых» изотерм, лежащих ниже. Такая температура Tк называется критической температурой, а соответствующая ей изотерма – критической изотермой.
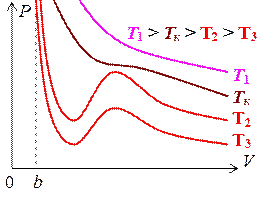

Рис. 3.9.1. Рис. 3.9.2.
Посмотрим, как уравнение Ван-дер-Ваальса описывает состояние реального газа. Для этого на одном рисунке изобразим изотерму Ван-дер-Ваальса и изотерму Эндрюса. Как видно из рисунка 3.9.2, изотерма Ван-дер-Ваальса (красная линия) и изотерма Эндрюса (синяя линия) практически совпадают при больших значениях V, соответствующих ненасыщенному пару. Качественно неплохо эти две кривые описывают жидкость. Вместе с тем изотерма Ван-дер-Ваальса не описывает область двухфазных состояний 14 (жидкость со своим насыщенным паром). Это объясняется неустойчивостью однородных состояний, отвечающих завитку 1-2-3-4. Рассмотрим эти неустойчивые состояния подробнее.
Процесс 2-3 неустойчив в принципе, т.к. в природе не существует веществ, для которых уменьшение объёма приводит к уменьшению давления, т.е. в этом случае наблюдается бесконечное сжатие вещества.
Процесс 1-2 отвечает состоянию перегретой жидкости. Такая жидкость при соблюдении специальных условий может существовать. В частности, если жидкость тщательно очистить от твердых примесей и растворенных в ней газов, то ее можно перевести в состояние с давлением, меньшим давления насыщенного пара, чтобы при этом жидкость не закипела. Такое состояние неустойчиво. Любая пылинка, попавшая в такую жидкость, приведет к ее бурному закипанию и переходу 2®2¢.
Процесс 3-4 отвечает состоянию пересыщенного пара. Такой пар, не содержащий посторонних включений, может находиться при давлении, большем давления насыщенного пара, т.е. при относительной влажности большей 100%. Это состояние неустойчиво и ведет к переходу 3®3¢ с конденсацией росы.
Выводы. Уравнение Ван-дер-Ваальса
1) хорошо описывает однофазные состояния (жидкость или ненасыщенный пар);
2) дает правильное представление о критическом состоянии вещества;
3) описывает такие экзотические состояния как перегретая жидкость или пересыщенный пар;
4) не описывает двухфазных состояний.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 683; Нарушение авторских прав?; Мы поможем в написании вашей работы!