
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критическое состояние вещества
|
|
|
|

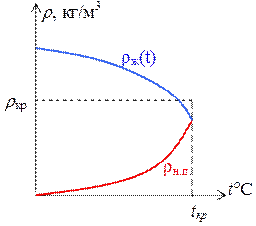
Рис. 3.8.1. Рис. 3.8.2.
Изотермы Эндрюса, полученные экспериментально, для различных температур приведены на рис. 3.8.1. Как видно из этого рисунка с увеличением температуры интервал объёмов, которым соответствует область насыщенного пара, сокращается и при некоторой температуре Tкр насыщенный пар вообще не образуется, а ненасыщенный пар при определенном объёме Vкр и определенном давлении Pкр будет сразу переходить в жидкое состояние. Такое состояние называется критическим, а соответствующие ему значения температуры, объёма и давления называются критическими температурой, объёмом и давлением. При температуре, большей критической, при любом сжатии газа жидкость не образуется.
Для воды критическая температура равна tкр = 374°С, критическое давление Pкр = 22,1 МПа, критическая плотность rкр = 329 кг/м3.
Зависимость плотности от температуры для жидкости и насыщенного пара приведена на рис. 3.8.2. Плотность жидкости с ростом температуры уменьшается по закону теплового расширения:
 . (3.8.1)
. (3.8.1)
Плотность насыщенного пара с увеличением температуры растет. Когда температура становится критической, плотности жидкости и насыщенного пара сравниваются. При критической температуре исчезает резкая граница между жидкостью и паром и теряется различие между ними. Можно дать следующее определение критической температуры.
Критической называется такая температура, при которой плотность насыщенного пара равна плотности жидкости.
Понятие критической температуры было впервые введено Д.И. Менделеевым в 1860 году.
Изображенная штрихом на рис. 3.8.1 колоколообразная кривая ограничивает область двухфазных состояний вещества. Колоколообразная кривая и критическая изотерма делят PV-плоскость на три области (рис. 3.8.3):
1) жидкость (синяя штриховка)
2) область двухфазных состояний - жидкость + насыщенный пар (зеленая штриховка)
3) газообразное состояние. Ниже критической изотермы ненасыщенный пар (красная штриховка), выше – газ (лиловая штриховка).
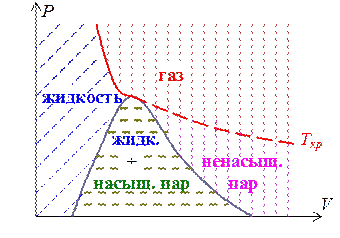
Рис. 3.8.2.
Разделение на газы (постоянные газы) и пары – условно. Оно исторически связано с тем, что большинство газов (в частности, газы, входящие в состав воздуха) невозможно было превратить в жидкость путем одного только сжатия.
Первым, кто понял, что для сжижения газов их нужно сначала охладить, а потом сжать, был М. Фарадей. В 1823 году он превратил в жидкость хлор, позже он получил жидкий сероуглерод и углекислый газ. Только некоторые газы, такие как кислород, азот, водород и гелий, никак не поддавались сжижению. Лишь после того, как Д.И. Менделеевым в 1860 году было введено понятие критической температуры, было понято, что газы следует сначала охладить до температуры меньшей критической, только тогда их можно превратить в жидкость с помощью сжатия. Так называемые «постоянные газы» не удавалось превратить в жидкость, т.к. их критические температуры достаточно низкие (много меньше комнатных). В таблице приведены значения критических температур таких газов и год, когда их впервые смогли превратить в жидкость.
| газ | Tк, К | год |
| азот | 126,3 | |
| кислород | 154,8 | |
| водород | 33,2 | |
| гелий | 5,2 |
Таким образом, обычные газообразные вещества, находящиеся при комнатной температуре, имеют критическую температуру, гораздо меньшую комнатной. Наоборот, вещества, которые мы привыкли считать жидкостями, имеют критическую температуру, больше комнатной. Так, в частности на Венере, если и существует вещество, химическая формула которого H2O, то, т.к. температура на поверхности Венеры t = 480°С > tкр = 374°С, не существует жидкой воды.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!