
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения и экспериментальные обоснования молекулярно-кинетической теории
|
|
|
|
1. Основные положения молекулярно-кинетической теории. Идеи о строении материи из мельчайших частиц, сохраняющих ее свойства, имеют древнегреческое происхождение. Живший в V в. до н.э. мыслитель Демокрит утверждал: «Ничего не существует, кроме атомов и пустого пространства; все прочее - мнение» и «различие всех предметов состоит в различии их атомов в числе, величине, форме и порядке...». Слово “атом” в переводе означает “неделимый”.
В основе молекулярно-кинетической теории лежат три постулата (положения), принимаемые как результат наблюдений и опытов:
1. Все виды вещества состоят из молекул, между которыми имеются промежутки;
2. Молекулы в любом веществе непрерывно и хаотически движутся;
3. На небольших расстояниях между молекулами действуют как силы притяжения, так и силы отталкивания, имеющие электромагнитную природу.
Эти утверждения подтверждаются такими явлениями как, например:
– сжимаемость тел;
– диффузия;
– Броуновское движение;
– теплопроводность;
– сопротивление сжатию и растяжению.
2. Размеры и масса молекул. Если на спокойную поверхность воды поместить каплю нерастворимой в воде жидкости, то образуется пленка, толщина которой равна диаметру одной молекулы. Размеры молекул удобно выражать в ангстремах:
1 А° = 10 -10 м.
Например, молекула кислорода O2 имеет диаметр 1,2 А°, а молекула воды H2O - 2,6 А°.
Поскольку масса молекул тоже мала (например, у кислорода O2 она равна 5,35·10-26 кг, а у водорода H2 - 3,34·10-27 кг), то ее удобно выражать в относительных единицах.
Атомной единицей массы называется 1/12 массы изотопа углерода C12 .
1 а.е.м. = 1,66·10 -27 кг.
Относительные массы атомов указаны в таблице Менделеева. Полезно запомнить округленные относительные массы некоторых элементов:
|
Относительную молекулярную массу вещества принято обозначать Mr. Для ее вычисления требуется установить, сколько атомов тех или иных элементов содержит молекула.
Пример 1. Молекула серной кислоты H2SO4 содержит два атома водорода, один атом серы (32 а.е.м.) и четыре атома кислорода, поэтому:
Mr = (1·2+32+16·4) а.е.м. = 98 а.е.м.
Иногда бывает важно учитывать число молекул, содержащихся в данном теле, т.е. количество вещества:
[ ] = моль.
] = моль.
Молем называется количество вещества, масса которого в граммах равна его относительной молекулярной массе.
Масса одного моля данного вещества называется молярной:
[µ] = г/моль.
Молярная масса вычисляется аналогично относительной молекулярной массе, но имеет другую размерность.
Пример 2. Молекула углекислого газа CO2 содержит один атом углерода и два атома кислорода, поэтому:
µ = (12+16·2) г/моль = 44 г/моль.
Пример 3. Воздух является смесью газов, процентное содержание которых необходимо учитывать при вычислении его молярной массы:
|
Поскольку другие компоненты (аргон, углекислый газ, гелий, водород, водяной пар и др.) составляют всего 1%, то их содержанием можно пренебречь. Тогда получаем:
µвозд = (28·0,78 + 32·0,21) г/моль  29 г/моль.
29 г/моль.
Полученное значение следует запомнить и использовать при решении задач.
Если известна масса вещества, то количество вещества может быть найдено по формуле:

Число молекул, содержащихся в одном моле любого вещества, есть величина постоянная и равно числу Авогадро:
NА = 6·10 23 моль-1.
Количество молекул, содержащихся в веществе, может быть найдено по формуле:

При нормальных условиях один моль любого газа занимает объем:
Vµ = 22,4 л/моль.
В дальнейшем под нормальными условиями будем понимать такое состояние газа, при котором:
p = 1 атм,
t = 0°C.
Под идеальным понимается такой газ, силами притяжения между молекулами которого можно пренебречь, а объем, занимаемый молекулой, равен нулю.
Одним из параметров, определяющих состояние газа, является давление:
[p] = Па.
Давление газа обусловлено ударами молекул о стенки сосуда.
Прибор для измерения давления называется манометром. Большие давления измеряются металлическим манометром, а маленькие - закрытым жидкостным. Для измерения атмосферного давления служит барометр.
Миллиметр ртутного столба - давление, производимое столбом ртути высотой 1 мм на горизонтальную поверхность.
Давление столба жидкости вычисляется по формуле:

Подставляя в нее плотность ртути 13600 кг/м3 и высоту столба 0,001 м, получаем:
1 мм рт. ст. = 133,3 Па.
Атмосфера физическая введена по среднегодовому атмосферному давлению на уровне моря, которое составляет 760 мм рт. ст.
Поскольку давление равно отношению силы к площади поверхности, на которую она действует, атмосфера техническая была введена следующим способом:

где кГс (килограмм-сила) - сила равная весу тела массой один килограмм.
1. Основное уравнение молекулярно-кинетической теории. Давление газа может быть выражено через величины, характеризующие молекулы.
Величину

называют среднеквадратической скоростью молекул.
Концентрацией называется количество молекул в единице объема.
[n] = м -3
В соответствии с определением концентрация может быть вычислена по формуле:


Полученное соотношение называется основным уравнением молекулярно-кинетической теории газа. Обычно его записывают иначе. Если учесть, что средняя кинетическая энергия молекул равна:

то:
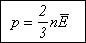
Значение данного уравнения состоит в том, что в нем давление - макроскопический параметр, характеризующий состояние газа как совокупности огромного числа молекул, выражается через микроскопический параметр (относящийся к отдельным молекулам) - среднюю кинетическую энергию.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 609; Нарушение авторских прав?; Мы поможем в написании вашей работы!