
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная теория химической связи
|
|
|
|
Химическая связь – любое взаимодействие между двумя или более частицами, сопровождающееся выделением энергии.
Под химической связью обычно понимают совокупность сил, удерживающих два и более атома в устойчивой многоатомной системе (молекуле, молекулярном ионе и т. д.).
Образование химической связи в отличие от межмолекулярного взаимодействия сопровождается существенной перестройкой электронных оболочек связывающихся атомов. Это отличие проявляется не столько в энергии связи, длине связи, сколько в ряде других физических и химических (спектроскопических, магнитных, электрических и др.) свойств системы, которые более чувствительны к происхождению связи и по совокупности составляют экспериментальный критерий ее проявления.
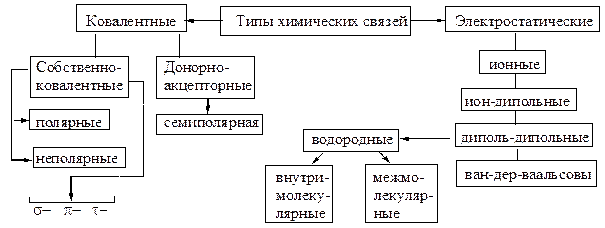
В органических соединениях преобладает ковалентная связь. Именно присутствием ковалентной связи объясняется резкое отличие свойств органических соединений от неорганических.
Неорганические соединения с электровалентной связью:
· высокополярны;
· часто солеобразны;
· в водных растворах электропроводны;
· имеют высокие температуры плавления и кипения;
· представляют собой в основном твердые вещества, образующие ионные кристаллические решетки.
Органические соединения, образованные с помощью ковалентных связей:
· малополярны;
· как правило, плохо растворимы в полярных растворителях;
· имеют низкие температуры плавления и кипения;
· формируют молекулярные кристаллические решетки;
· не обладают электропроводностью.
Подобные отличия проистекают из определенных свойств ковалентной связи. Ковалентная связь характеризуется:
· длиной;
· валентным углом;
· энергией;
· полярностью;
· поляризуемостью;
· насыщаемостью;
· направленностью в пространстве.
Под длиной связи понимают равновесное расстояние между ядрами связанных атомов. Половина длины связи в симметричной молекуле называется ковалентным радиусом.
Валентный угол – угол между воображаемыми линиями, проходящими через ядра химически связанных атомов.
Энергией связи называют энергию (Е), выделяющуюся при образовании молекулы из одиночных атомов.
Полярность связи (статическая поляризация) отражает взаимное влияние непосредственно связанных атомов. Для электроотрицательности используют шкалу Полинга (табл. 1).
Таблица 1 – Значение электроотрицательностей некоторых элементов
(по Полингу)
| Na | Li | Mg | Si | B | H | P | S | C (sp3) | I | C (sp2) | Br | N | Cl | C (sp) | O | F |
| 0,9 | 1,0 | 1,2 | 1,8 | 2,0 | 2,1 | 2,1 | 2,5 | 2,5 | 2,6 | 2,8 | 2,8 | 3,0 | 3, | 3,1 | 3,5 | 4,0 |
Количественно полярность можно охарактеризовать величиной дипольного момента, которая показывает степень разделения зарядов. Дипольный момент является вектором и обозначается в виде стрелки, направленной от положительного к отрицательному. Дипольный момент молекулы представляет геометрическую сумму дипольных моментов отдельных связей:
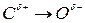
Поэтому некоторые симметричные молекулы неполярные, несмотря на присутствие полярных связей (μ = 0):
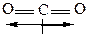
Полярность связи имеет непосредственное отношение к реакционной способности соединения.
Поляризуемостью (динамическая поляризация) – это способность электронной оболочки атома или молекулы деформироваться под воздействием внешнего поля, в качестве которого могут выступать ионы или полярные молекулы.
Для органических соединений была приспособлена разработанная Г. Льюисом и В. Косселем (1916 г.) теория образования неорганических ионных соединений, т. е. принцип дублета-октета, которая применима, если не рассматривать атомы высших периодов. И. Ленгмюр (1919 г.) ввел понятие ковалентная связь (в противопоставление ионной связи), под которой понимается связь образованная общей парой электронов. Общая электронная пара ковалентной связи может быть образованна несколькими способами:
· коолигация электронов;
· координация электронов.
В первом случае – каждая частица предоставляет по одному неспаренному электрону:
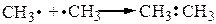
Во втором случае – одна частица дает электронную пару, вторая предоставляет незаполненную орбиталь, т. е. происходит перераспределение электронной плотности:

В органической химии связь, образовавшуюся в результате координации двух нейтральных частиц, называют семиполярной. Фактически эта связь является ковалентной, соединяющей атомы, на которых при возникновении связи образуются положительный и отрицательный заряды:

Квантово-механическое описание химической связи. В основе современной химической связи лежит физико-математическая теория, получившая название квантовая (волновая) механика. Исходной предпосылкой этой теории является представление о двойственной природе электрона. Волновые свойства электрона доказаны экспериментально, поэтому его движение можно описать с помощью волновой функции ψ, которая может быть положительной, отрицательной и мнимой величиной. Интенсивность волновой функции |ψ|2 означает, что вероятность нахождения электрона в данной точке пропорциональна квадрату абсолютного движения волновой функции для этой точки.
Математически поведение электрона в атоме может быть описано с помощью волнового уравнения (1926 г. Э. Шредингер):
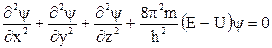 ,
,
где ψ – волновая функция электрона; m – масса; Е – полная энергия системы; U – потенциальная энергия; h – постоянная Планка.
В связи с решением уравнения Шредингера возникают два основных вывода:
· уравнение имеет бесконечное множество решений, т. е. может быть решено лишь для некоторых значений, при которых ψ имеет физический смысл. Следовательно, из волнового уравнения автоматически вытекает существование дискретных энергетических уровней, которые может занимать электрон;
· при решении уравнения для атома водорода возникают квантовые числа n, l, m, ms. Каждому из дозволенных сочетаний квантовых чисел соответствует определенная атомная орбиталь (АО).
Любая АО может быть в трех состояниях:
· вакантной;
· занятой одним электроном;
· занятой двумя электронами с антипараллельными спинами, т. е. НЭП.
Атомная орбиталь (АО) – часть пространства, в котором вероятность нахождения электрона максимальна.

Рисунок 1 – Формы орбиталей
При образовании химической связи АО перекрываются, теряя свою индивидуальность и образуя молекулярную орбиталь (МО), которая занята общим электроном. Освобождающаяся при этом энергия тем больше, чем больше степень перекрывания АО.
Таким образом:
· за возникновение химической связи ответственно одновременное взаимодействие электронов с двумя (и более) ядрами;
· движущей силой образования связи является выигрыш в энергии системы по сравнению с суммой изолированных атомов.
Вычислить снижение энергии системы при взаимодействии атомов и теоретически определить распределение электронной плотности в молекуле позволяет уравнение Шредингера.
Точное решение этого уравнения сделать невозможно из-за трудностей, связанных с соотношением неопределенности Гейзенберга, поэтому разработаны приближенные методы математического решения уравнения Шредингера, известные как метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Метод валентных связей. В этом методе учитывают, что атомы в молекулах сохраняют индивидуальность, а эффект химической связи рассматривается как возмущение, приводящее к обмену электронами в соответствии с принципом Паули. ВС строятся из АО, т. е вводится понятие валентного состояния атома, количество пар электронов, связывающий данный атом с другими, определяет его валентность.
Основное состояние молекулы описывается волновой функцией:
 ,
,
где 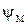 – молекулярная волновая функция;
– молекулярная волновая функция;  ,
, 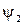 ,
, 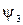 – волновые функции соответствующих резонансных структур;
– волновые функции соответствующих резонансных структур; 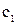 ,
,  ,
,  – коэффи-циенты, выражающие вклад резонансных структур в смешанное состояние.
– коэффи-циенты, выражающие вклад резонансных структур в смешанное состояние.
Квадрат молекулярной волновой функции 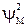 дает распределение электронной плотности в молекуле.
дает распределение электронной плотности в молекуле.
Аналогично проводится расчет зарядов на атомах:
 ,
,
где  – заряд на одном атоме резонансной структуры, а
– заряд на одном атоме резонансной структуры, а 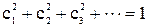 .
.
Порядок связей,оценивающий величину связанности атомов, образующих связь, определяют по формуле:
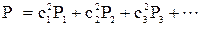 .
.
Метод молекулярных орбиталей. В соответствии с методом молекулярных орбиталей (МО) молекула рассматривается как единая система ядер и электронов, где каждый электрон движется в поле всех ядер и всех остальных электронов.
Молекулярная орбиталь (МО) –многоцентровая орбиталь, образовавшаяся в результате перекрывания двух и более атомных орбиталей.
| МО | электроны |
| σ – связывающая | σ – электроны |
| π – связывающая | π – электроны |
| n – несвязывающая гибридная | n – электроны |
| n – несвязывающая p z- или p у- МО | p – электроны |
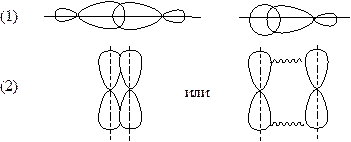

Рисунок 2 – Способы перекрывания АО. 1. Осевое перекрывание → σ -связь; 2. Боковое перекрывание → π -связь; 3. Частично боковое перекрывание → τ -связь.
Описание молекулы методом МО включает определение типов ее орбиталей, их энергий, распределение электронов по МО в порядке возрастания энергии. В простейшем случае их можно представить как линейную комбинацию (алгебраическую сумму) атомных орбиталей (ЛКАО). Поскольку молекулярная орбиталь – это волновая функция отдельного электрона в молекуле, то ее можно представить как:
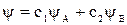 ,
,
где  и
и  – волновые функции АО орбиталей атомов А и В;
– волновые функции АО орбиталей атомов А и В; 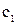 и
и 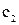 – орбитальные коэффициенты, определяющие вклад АО в МО.
– орбитальные коэффициенты, определяющие вклад АО в МО.
Связывающие и разрыхляющие МО. При сближении двух атомов их волновые функции накладываются, что может привести либо к увеличению волны колебаний (амплитуда одного знака), либо к уменьшению (амплитуда разного знака).
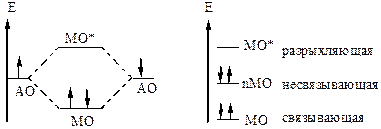
Рисунок 3 – Схема образования МО
Поскольку электрон обладает волновыми свойствами наложение волновых функций можно сравнить с интерференцией (от лат. inter – взаимно, ferio – поражаю) волн. Если при образовании МО АО находятся в положительной интерференции орбиталь называют связывающей МО (ψ+). Электронная плотность в связывающей МО как бы «натекает» в межъядерное пространство обеспечивая химическую связь, понижая энергию молекулы и повышая ее устойчивость.

Рисунок 4 – Перекрывание АО ведущее к связыванию
В областях пространства, где волновые функции взаимодействующих атомов находятся в отрицательной интерференции (волновые функции атомов вычитаются), образуются разрыхляющие (антисвязывающие) МО (ψ–).
Электроны, заполняющие разрыхляющую орбиталь, находятся, главным образом, снаружи ядер атомов и стремятся растянуть связь (если между ядрами небольшая электронная плотность – возникает узел). Заселение разрыхляющих орбиталей приводит к повышению энергии молекулы и к понижению ее устойчивости.
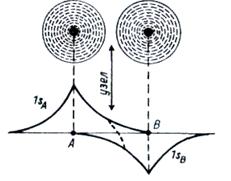 |
Рисунок 5 – Образование антисвязывающей (разрыхляющей) МО
Количество МО образующейся молекулы равно количеству взаимодействующих АО.
Условия возникновения МО. Молекулярные орбитали возникают при наложении АО, удовлетворяющих следующим условиям:
· взаимодействовать могут АО достаточно протяженные в пространстве, что обеспечивает их взаимное перекрывание;
· перекрывающиеся АО должны иметь близкие энергии;
· АО должны иметь одинаковую симметрию относительно вращения вокруг линии связи в молекуле. Если при повороте орбитали на 180о вокруг линии связи знак волновой функции не изменяется, орбиталь называют симметричной; при изменении знака – антисимметричной. Атомные орбитали с различной симметрией не могут образовывать МО.
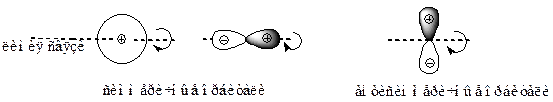
Рисунок 6 – Симметричные и антисимметричные АО
Электроны, размещенные на π - МО, образуют более слабые связи, чем расположенные на σ-МО, т. к. накопление электронной плотности происходит не на линии связывающей центры атомов, и ядра испытывают менее сильное взаимное притяжение.
Построение молекулярных функций для многоатомных систем, к которым относятся органические молекулы, заключается в составлении линейных комбинаций АО. Электроны на МО делокализованны между несколькими атомами, входящими в состав молекулы.
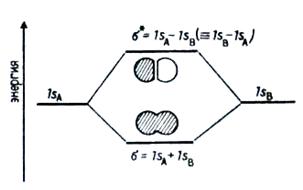
Рисунок 7 – Диаграмма энергетических уровней МО, образованных из 1s –орбитали
Молекула метана СН4 имеет симметричную форму, атом углерода находится в состоянии sp3 гибридизации. Взаимодействие гибридизованной АО углерода и 1s АО атома водорода будет приводить к образованию одной связывающей и одной разрыхляющей МО. Т. о. при образовании молекулы метана возникает восемь МО и все восемь электронов молекулы метана располагаются на связывающих МО (рис. 8).
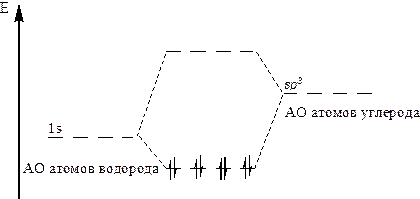
Рисунок 8 – Связывающие МО метана (испытывают взаимное отталкивание)
Согласно теории возмущения М. Дьюара происходит взаимное отталкивание между четырьмя равными по энергии связывающими орбиталями, что приводит к расщеплению уровня на два подуровня (на одном – одна орбиталь, на другом – три). Аналогично происходит расщепление разрыхляющих орбиталей (рис. 9).
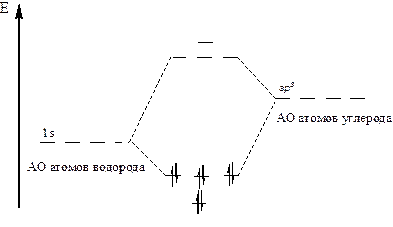
Рисунок 9 – Связывающие МО метана
Взаимодействие между орбиталями приводит к понижению энергии одних при равном увеличении энергии других, общая энергия связывающих МО не изменяется.
Квантово-механические расчеты приводят к каноническим орбиталям, для которых характерна высокая степень делокализации. Канонические орбитали принадлежат не отдельным связям, а охватывают все атомы или группу атомов в молекуле.
При рассмотрении канонических орбиталей молекулы метана (рис. 10) самая нижняя связывающая орбиталь ψ1 охватывает все пять ядер, входящих в состав молекулы. Это самая связывающая МО. Выше располагаются три вырожденные орбитали (ψ2, ψ3, ψ4). Они имеют по одной узловой плоскости, проходящей через атом углерода. Орбитали ψ5, ψ6, ψ7 имеют больше угловых плоскостей, т. о. соблюдается правило: чем больше узлов (узловых плоскостей), тем выше энергия орбитали. Самая разрыхляющая ψ8 – орбиталь имеет узлы между каждой парой атомов углерода и водорода. Совмещение всех занятых молекулярных орбиталей дает общую картину распределение электронной плотности в многоэлектронных молекулах.
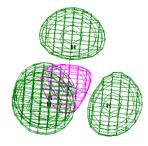 ψ8
ψ8
| __ +431 ккал/моль | Разрыхляющие МО | ||
 ψ5
ψ5
|  ψ6
ψ6
|  ψ7
ψ7
| __ __ __ +402 ккал/моль | |
 ψ2 ψ2
|  ψ3 ψ3
|
 ψ4 ψ4
| 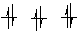 –304 ккал/моль
–304 ккал/моль
| Связывающие МО |
 ψ1 ψ1
| 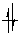 –583 ккал/моль
–583 ккал/моль
|
Рисунок 10 – Схема канонических орбиталей молекулы метана
Высшие занятые (ВЗМО) и низшие свободные (НСМО) молекулярные орбитали наиболее сильно изменяются при каких-либо воздействиях на молекулу. ВЗМО и НСМО называются граничными орбиталями. Наиболее важной характеристикой граничных орбиталей является электронная плотность на отдельных атомах, называемая граничной электронной плотностью, или индексом реакционной способности. Для удаления электронна с ВЗМО требуется меньше энергии, чем для отрыва электронов с более низких молекулярных орбиталей. Поэтому в реакциях с электрофильными реагентами (катионами и окислителями) главным образом участвуют электроны ВЗМО. В реакциях с нуклеофильными реагентами (анионами и восстановителями) участвуют электроны НСМО.
Основной постулат теории граничных орбиталей (К. Фукуи, 1952 г.) гласит, что реакции легче всего протекают в случае максимального перекрывания граничных МО субстрата и реагента. Перекрывание приводит к переносу электронов ВЗМО донора на НСМО акцептора. При электрофильной реакции взаимодействие происходит преимущественно по положению, в котором граничная электронная плотность ВЗМО наибольшая.
Для оценки реакционной способности необходимо определить виды граничных МО взаимодействующих молекул при помощи квантово-химических расчетов. При этом, σ -МО в основном стабилизируют молекулу, но не определяют ее химические свойства.
Поэтому на молекулярных энергетических диаграммах молекул σ -МО часто опускают. Особенно это касается сопряженных π -электронных систем. Такой вид рассмотрения молекул называют π -приближением.

Рисунок 11 – Графическое изображение МО
Понятие о гибридизации. Валентные состояния атома углерода. Идея предсказания структурных формул молекулы формулируется в теории отталкивания следующим образом: пары электронов на валентной оболочке атома отталкивают друг друга и атомы располагаются таким образом, чтобы уменьшить отталкивание.
В 1928 – 1931 г. Л. Полинг и Дж. Слейтер ввели понятие гибридизации атомных орбиталей. Гибридизация – метод математического комбини-рования различных по форме и энергии орбиталей с образованием такого же количества новых, но уже одинаковых по форме и энергии гибридных орбиталей.
Условием устойчивой гибридизации является энергетическая близость, достаточная близость и степень перекрывания.
В соединениях атом углерода может находиться в одном из трех валентных состояний.
Наиболее выгодна sp3 -гибридизация, т. к. в полной мере реализуется принцип:
· максимального перекрывания орбиталей;
· максимального удаления всех орбиталей.
Таблица 2 – Схема гибридизации АО
| Вид | Схема образования гибридизации АО | Электронная конфигурация атома | Вал. угол | Примечание |
| sp3 | 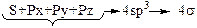 (доля S-орбитали 25%) (доля S-орбитали 25%)
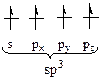
|  Тетраэдрическая
Тетраэдрическая
| 109o | Тетрагональный атом, первое валентное состояние. Соответствует простое вещество – алмаз. |
| sp2 | 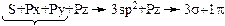 (доля S-орбитали 33%) (доля S-орбитали 33%)

|  Копланарная
(плоская)
Копланарная
(плоская)
| 120o | Тригональный атом, второе валентное состояние. Соответствуют простые вещества графит и фуллерен. |
| sp | 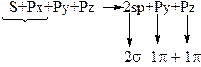
 (доля S-орбитали 50%) (доля S-орбитали 50%)
| 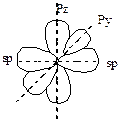 Линейная Линейная
| 180o | Дигональный атом, третье валентное состояние. Соответствует простое вещество – карбин. |
Сравнительная характеристика sp3-, sp2-, sp – гибридизованных атомов:
| sp3- | sp2- | sp- | |
| Доля s -орбитали Атомный радиус Электроотрицательность Эффективность осевого перекрывания АО Энергия образования связи С–С (прочность связи) | 




|
Определение типа гибридизации (по структурной формуле):
1. По количеству партнеров. Партнер – соседний атом и свободная электронная пара.
· 4 партнера соответствуют sp3 -гибридизации (4 σ -связи);
· 3 партнера соответствуют sp2 -гибридизации (связь двойная);
· 2 партнера соответствуют sp -гибридизации (связь тройная).
2. Для атомов с 4-мя партнерами, среди которых электронная пара, учитывается гибридизация партнера. В случае sp2 -гибридизации партнера для характеризуемого атома более выгодна sp2 -гибридизация, т. к. реализуется возможность делокализации электронной пары по сопряженной системе и, как следствие, снижения энергии.
Т. о., существуют два типа sp2 -гибридизованных атомов:
Пиридиновый атом – sp2 -гибридизованный атом с 3-мя партнерами (с двойной связью), у которого на рz -орбитали один электрон (свободная пара электронов на sp2-гибридной орбитали).
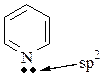
Пиррольный атом – sp2 -гибридизованный атом с 4-мя партнерами, у которого на рz -орбитали два электрона, участвующих в сопряжении.
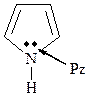
Долгое время считали, что гибридизация – один из формальных подходов, позволяющий объяснить строение молекул. В настоящее время показано, на примере sр2– гибридизации (метод разностной электронной плотности), что гибридизация существует реально.
С изменением типа гибридизации углеродного атома изменяются его свойства. При переходе от sр3– к sр2– гибридизации изменяется форма гибридной орбитали, так как возрастает доля s– орбитали в составе гибридизованной орбитали. Это приводит к уменьшению ковалентного радиуса, поэтому длинна С–С связи в соединениях СH3–СH2–СH3, СH3–СH=СH2, СH3–С≡СH различна (0,154 нм, 0,133 нм, 0,121 нм соответственно).
Равноценность атомов углерода. Атомы углерода равноценны, если они одинаковы по характеру и одинаковы по характеру их соседи.
По характеру атомы углерода бывают:
· первичные, соединенные с одним атомом углерода;
· вторичные, соединенные с двумя атомами углерода;
· третичные, соединенные с тремя атомами углерода;
· четвертичные, соединенные с четырьмя атомами углерода.
Атом водорода называют:
· первичным, если он соединен с первичным атомом углерода;
· вторичным, если он соединен со вторичным атомом углерода;
· третичным, если он соединен с третичным атомом углерода;
· винильным, если он соединен с sp2 -гибридизованным атомом углерода винильного фрагмента:
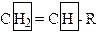
· ацетиленовым, если он соединен с sp -гибридизованным атомом углерода (обуславливает кислотные свойства ацетиленов):

- бензильным, если находится у атома углерода, связанного с ароматическим ядром:
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1595; Нарушение авторских прав?; Мы поможем в написании вашей работы!