
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Развитие неорганической и аналитической химии
|
|
|
|
Основные направления развития химии в XX столетии
Основой развития неорганической химии в XX в. являлся по-прежнему Периодический закон Д. И. Менделеева. Число известных элементов в начале века составляло 110, а число неорганических соединений – несколько сотен тысяч. Методы получения и исследования неорганических соединений, применявшиеся в XIX столетии, были значительно усовершенствованы. Были разработаны совершенно новые методы с применением высоких и низких давлений и температур, электрических полей, радиации и т. д. Особое значение получили каталитические реакции и получение особо чистых веществ. Содержание примесей удалось снизить до 10–5 (то есть одна молекула загрязняющего вещества на 100 000 молекул основного вещества). Высокая степень очистки позволила найти новые области применения для чистых веществ. Характерная черта развития химии в XX веке – возрастающая связь с потребностями промышленности. В результате этого были значительно усовершенствованы производства кислот, щелочей, удобрений, сплавов металлов. Возникли новые производства минеральных веществ: полимеров, полупроводников и других материалов.
Координационная теория. Большое внимание из неорганических веществ было уделено изучению строения координационных (комплексных) соединений (гидраты, аммиакаты, двойные соли и другие). Термин «комплексные соединения» предложен в 1889 г. Строение этих соединений изучали многие ученые, но основная заслуга в этом принадлежит швейцарскому химику Альфреду Вернеру (1866-1919 г.г.).
В 1913 г. шведский король Густав V вручил А. Вернеру медаль лауреата Нобелевской премии. В дипломе указывалось, что премия присуждена А. Вернеру «…в признание его работ о природе связей в молекулах, которыми он осветил старые проблемы и открыл новые области для исследований, особенно в неорганической химии». В 1893 г. А. Вернер предложил теорию, обобщающую результаты исследований его предшественников и назвал ее координационной. В течение дальнейших 25 лет ученый развил важные положения теории и подтвердил их экспериментально. Главное положение его теории состоит в признании факта, что молекулы, у которых исчерпана «соединительная способность» с точки зрения классической теории валентности, могут принимать участие в построении сложных молекул. Такая возможность связана с проявлением «побочной валентности». А. Вернер ввел понятие о комплексном ионе, лигандах, координационном числе. В своей обобщающей работе «Новые воззрения в области неорганической химии» (1905 г.) ученый изложил теорию и экспериментальный материал, подтверждающий ее. Он показал, что элементы платина (IV), кобальт (III), иридий (III), хром (III) обладают координационным числом 6, а платина (II), палладий (II), медь (II) – координационным числом 4. А. Вернер, используя метод определения электропроводности соли, установил число ионов в соединениях и тем самым состав внутренней координационной сферы.
Существенной частью координационной теории А. Вернера является положение, касающееся стереохимии комплексных соединений. Молекулы и ионы, связанные с центральным ионом «побочными валентностями», располагаются вокруг него в пространстве, как в кристалле, так и в растворе. Для каждого координационного числа ученый определил тип и форму кристаллической решетки. Им были предсказаны, а затем и получены цис- и транс-изомеры для соединений с координационным числом 6: Co[(NH3)2Cl4]. Теория А. Вернера наглядно объяснила строение множества комплексных соединений и легла в основу их классификации.
Представления о природе химической связи. Первой попыткой объяснить природу химической связи с позиции электронных представлений была идея, высказанная Р. Аббергом (1869-1910 г.г.) и Г. Бодлендером (1856-1904 г.г.) о сродстве атомов к электрону. На этой основе Р. Абберг в 1904 г. развил представления об электровалентности. Такой валентностью обладают ионы, и величина заряда определяет их валентность. Максимальная валентность элементов (и ионов) определяется их положением в Периодической системе.
Большое значение для дальнейшей разработки этой проблемы имели работы, вышедшие в 1916 г. Одна из них принадлежит В. Косселю (1888-1956 г.г.), вторая – американскому физико-химику, члену Национальной академии наук Гилберту-Ньютону Льюису (1875-1946 г.г.). В. Коссель, рассматривая соединение атома щелочного металла с атомом галогена, высказал идею, что электрон внешней оболочки металла переходит к галогену. При этом два противоположно заряженных иона соединяются.
Кислотой Льюиса называют частицу (ион, молекулу), обладающую способностью присоединять к себе пару электронов. Если кислота «жесткая», то она имеет маленький размер, низкую поляризуемость, высокую степень окисления одного из ее атомов. Например, в реакции

трифторид бора является кислотой Льюиса, а молекула аммиака – основанием Льюиса.
«Мягкая кислота» – частица, обладающая большим размером, высокой поляризуемостью, низкой степенью окисления одного из ее атомов. Например, катион золота Au+, трихлорид галлия GaCl3, иод I2, бром Br2 – «мягкие кислóты».
Г. Льюис высказал мысль о возможности существования двух типов соединений с полярной и неполярной связью. Он считал, что химическая связь – это пáра электронов, удерживаемая совместно двумя атомами в молекуле. Строение некоторых соединений по Льюису:

Он допустил, что химическая связь может образоваться не только при передаче валентных электронов, но и при их спаривании. Такая связь по предложению И. Лэнгмюра (1881-1957 г.г.) получила название «ковалентная».
Кроме кислот Льюиса существуют также кислóты Бренстеда. Йоханнес-Николаус Бренстед (1879-1947 г.г.) – датский физико-химик, член Датского Королевского Научного общества. Кислота Бренстеда – это частица, способная отдавать протон (катион водорода) основанию Бренстеда. К подобным кислотам принадлежат соляная, серная и другие, содержащие катион водорода, легко уходящий от кислотного остатка при взаимодействии с растворителем. К таким кислотам принадлежит также катион аммония, гидроксония (Н3О+) и другие. Поведение подобных кислот в растворе Й.-Н. Бренстед описал уравнением:
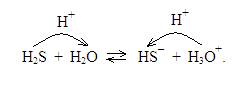
Со временем теория Льюиса-Ленгмюра получила дальнейшее развитие в трудах Н. В. Сиджвика (1873-1952 г.г.), который с помощью этой теории объяснил природу химической связи в комплексных соединениях.
Исследования отдельных классов неорганических веществ. В конце XIX в. были получены гидриды многих элементов. Долгое время не удавалось получить гидриды бора и кремния. В 1917 г. Альфред Шок сконструировал специальную вакуумную аппаратуру для получения неустойчивых на воздухе веществ, в том числе и гидридов. Он впервые получил гидриды кремния: SiH4, Si2H6, Si3H8, Si4H10 и другие.
В середине XX в. Г. Шлезингер получил первый двойной гидрид LiAlH4. Первый и простейший представитель гидридов бора В2Н6 был получен А. Штоком в 1912 г. В 50-60-е годы были разработаны методы получения высших бороводородов: В8Н18, В9Н15 и других.
Большой интерес к гидридам объясняется их важным практическим значением: они используются для изготовления реактивного топлива.
Быстрый прогресс в развитии химии элементов и классов соединений наблюдался в XX в. во всех областях неорганической химии. В 1933 г. Лайнус Полинг, американский химик, лауреат двух Нобелевских премий, исходя из термодинамических расчетов, предсказал возможность существования соединений благородных газов: криптона и ксенона. В 1960 г. И. Мост и А. Л. Кейс осуществили реакцию взаимодействия между криптоном и фтором. В 1962 г. Н. Бартлет получил соединение гексафторплатинат ксенона Xe(PtF6). При очистке гексафторида платины PtF6 от примеси бромидов, пропуская газообразный фтор, он получил новое соединение. Ученый предполагал, что выделяющийся бром должен превратиться в присутствие фтора в светло-желтый трифторид брома BrF3, который при охлаждении стал бы жидкостью:
NaBr + 2 F2 = NaF + BrF3↑.
Вместо этого ученый увидел выделение красных паров, которые превращались в красные кристаллы на холодных частях прибора. Объяснение этого явления ученому удалось найти только через два года. При долгом хранении на воздухе гексафторид платины взаимодействовал с кислородом, образуя при этом кристаллы оранжевого цвета – гексафторплатинат диоксигенила:
O2 + PtF6 = O2(PtF6).
При нагревании в токе фтора полученное вещество возгонялось в виде красного пара. Анализ этого явления привел Н. Бартлета к выводу о возможности синтеза соединений инертных газов. Несколько позднее Х. Классен, Х. Селиг, Дж. Г. Мальм синтезировали тетрафторид ксенона путем нагревания смеси ксенона и фтора при 400 °С.
В середине XX в. были синтезированы несколько неорганических соединений, ранее неизвестных: Al2O, AlF, HF3, NCl3, ICl, ICl2, ICl7, OF2, O2F2.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1233; Нарушение авторских прав?; Мы поможем в написании вашей работы!