
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пневматическая или газовая химия
|
|
|
|
Пневматической химии предшествовал длительный период пневматической алхимии. До XVIII в. химия не располагала никакими сведениями о составе атмосферного воздуха, который считался в те времена элементарным веществом. При изучении веществ в XV-XVII в.в. основное внимание уделяли таким свойствам вещества, как вес (масса), твердость, цвет, запах, вкус и некоторые другие. Приемы, которые применяли для исследования твердых и жидких веществ, оказались непригодными для исследования газов. Вплоть до XVIII в. Химики не умели собирать газы в закрытые сосуды. Сама мысль о том, что воздух является смесью газов, казалась им нереальной.
Г. Галилей в 1637 г. установил, что воздух в 400 раз легче воды. Затем Роберт Бойль определил относительные плотности воздуха и воды (он получил значения 938:1; 650:1; 1228:1). Роберт Бойль совместно с Робертом Гуком, используя воздушный насос, определили массу и упругость воздуха. Они описали методы перегонки газов при пониженном давлении. Р. Бойль, так же, как и Дж. Мэйоу, наблюдал, что в отсутствие воздуха не могут существовать животные и гаснет свеча, накрытая непроницаемым колпаком.
Голландский доктор медицины, алхимик и теолог И. Б. Ван Гельмонт (1579-1644 г.г.) в 1620 году впервые ввел в науку понятие «газ». Он считал, что существуют газы, отличающиеся друг от друга и от воздуха, они содержатся в различных твердых телах и могут быть выделены из них.
Первым собрал газ методом вытеснения жидкости Р. Бойль в 1660 г. Таким способом он собрал водород, выделяющийся при действии соляной кислоты на железо. Он также собрал оксид азота (II), полученный им при действии разбавленной азотной кислоты на тот же металл - железо.
Мысль о том, что газы принимают участие во многих химических реакциях, приобретает реальный смысл только в начале XVIII века. Применяя кислоты и щелочи при обработке различных руд, минералов и солей стало появляться новое направление, которое привело к развитию химии газов.
В 1724 г. английский священник и ботаник Стефан Гейлс (1677-1761 г.г.) изобрел пневматическую ванну, с помощью которой ему удалось собирать чистые газы. В качестве «реактора» и одновременно газоотводной трубки он использовал изогнутый и закрытый с одного конца ствол ружья. Закрытый конец ствола с веществом нагревался, а открытый был помещен в ванну с водой. Над выходным отверстием ружья висела колба, заполненная водой, горло которой было погружено в воду. Газы, выделяющиеся при нагревании веществ в изогнутом стволе ружья, собирались в наполненной водой колбе, вытесняя при этом воду из нее.
4.2.1 Открытие углекислого газа («связанного воздуха»)
В 1756 г. вышла работа Дж. Блэка (1728-1799 г.г.), английского химика и врача, профессоров в университетах в г. Глазго и г. Эдинбурге. Называлась она «Эксперименты над белой магнезией негашеной известью и некоторыми другими щелочными веществами». Он впервые установил, что «мягкие щелочи» являются карбонатами металлов. Прокаливая навеску белой магнезии до постоянной массы, ученый получил остаток (MgO), который растворил в серной кислоте, а затем добавил раствор поташа (K2CO3). В результате реакции образовался осадок, который обладал свойствами белой магнезии (исходного вещества). Его масса оказалась почти такой же, как у взятой соли. Пользуясь современными формулами, эти операции можно выразить следующим образом:
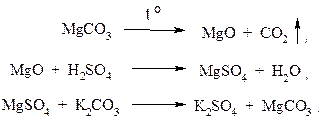
Дж. Блэк писал: «Магнезия растворяется в кислотах с выделением определенного газа и получает все свои свойства, которые потеряла при прокаливании. Масса возрастает ровно на столько, сколько ее было потеряно при прокаливании. Поскольку растворение в кислоте проходит с выделением газа, то часть массы общей навески обязательно принадлежит этому газу».
Это был пример первого исследования, когда газ участвует в реакции как составная часть химического процесса. И без учета этой части нельзя было составить материальный баланс всей реакции.
Дж. Блэк назвал выделяющийся газ (углекислый газ) «связанным воздухом». Он установил, что «связанный воздух» отличается от обыкновенного воздуха тем, что он тяжелее его и не поддерживает ни горения, ни дыхания. Ученый показал, что «связанный воздух» выделяется в процессе горения, дыхания, брожения и взаимодействует с известковой водой, приводя к ее помутнению.
Аналогичные опыты ученый проводил и с мелом. При этом он показал, что при обжиге мела происходит потеря около 44 % массы первоначально взятой навески вещества. Говоря современным языком, при обжиге 100 частей мела происходит потеря массы, равная 44 частям. То есть можно примерно представить, что выделяющийся газ имел такую массу, а это может быть только углекислый газ.
4.2.2 Открытие водорода («горючего воздуха»)
После работ Дж. Блэка многие химики в лабораториях Англии, Швеции, Франции, Германии занялись изучением газов. Больших успехов в этом достиг английский физик и химик Генри Кавендиш (1731-1810 г.г.). В первой его работе по химии газов (1766 г.) описаны свойства и получение водорода. Водород или «горючий воздух» был известен и раньше ученым: Р. Бойлю, Н. Лемери́, М. В. Ломоносову, но выделить этот газ и изучить его свойства никто до Г. Кавендиша не пытался.
В трактате «Три работы, содержащие опыты с искусственными видами воздуха» (1766 г.) он показал, что существуют газы, отличные от обычного воздуха. Г. Кавендиш получал водород действием разбавленных кислот на металлы. При действии различных кислот (соляной, серной) на различные металлы (цинк, железо) подучается один и тот же газ (водород). Это окончательно убедило Г. Кавендиша, что все металлы содержат «флогистон». Причем «флогистон» выделяется при окислении металлов. Он принимал водород за чистый «флогистон», поскольку тот горит, не оставляя остатка, и оксиды металлов, обрабатываемые этим газом, восстанавливаются в соответствующие металлы. Г. Кавендиш считал, что водород не вытесняется металлом из кислоты, а выделяется в результате разложения «сложного» металла. Эту реакцию он представлял так:
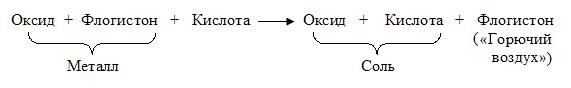
По мнению ученого «горючий воздух» «изгоняется» кислотами из металлов, подобно тому, как выделяется «связанный воздух» при действии кислоты на известняк или магнезию. Г. Кавендиш описал свойства водорода. Газ не растворяется в воде, образует с воздухом взрывоопасную смесь, плотность его в 11 раз меньше, чем у воздуха (по современным данным плотность его меньше в 14,4 раза, чем у воздуха).
4.2.3 Открытие кислорода («огненного воздуха»)
С кислородом химики сталкивались давно, но установить природу газа им не удавалось. Первым кислород получил голландский алхимик и технолог Корнелиус - Якобсон Дреббел (1572-1663 г.г.) путем нагревания нитрата калия:
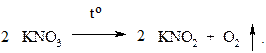
В 1772 г. Карл - Вильгельм Шéеле (1742-1768 г.г.) выделил кислород, используя реакцию взаимодействия оксида марганца (IV) c серной кислотой:
2 MnO2 + 2 H2SO4 → 2 MnSO4 + 2 H2O + O2↑.
Полученный газ К. Шéеле назвал «огненным воздухом».
В 1774 г. Джозеф Пристли (1733-1804 г.г.) обнаружил выделение неизвестного газа при нагревании оксида ртути (HgO) и оксида свинца (Pb3O4). Он изучил его свойства и обнаружил, что газ поддерживает горение. Реакция разложения оксида ртути протекала по уравнению:
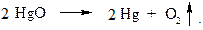
Почти одновременно с Дж. Пристли в этой области работал и Карл Шéеле. Он несколько ранее (в 1770-1773 г.г.) получил кислород и описал его свойства, поскольку почти ничего не знал о работах Дж. Пристли. Дж. Пристли, открывший кислород, не имел ясного представления о его природе и присвоил ему название «дефлогистированный воздух», то есть лишенный флогистона. Термин «огненный воздух» принадлежит К. Шéеле. Приоритет в открытии газа закреплен за двумя учеными: К. Шéеле и Дж. Пристли.
К. Шéеле получал кислород нагреванием селитры или нитрата магния, а также перегонкой смеси селитры и серной кислоты. Он обнаружил, что этот газ поддерживает дыхание и горение. К. Шéеле писал: «Этот газ состоит из кислой тонкой материи, соединенной с флогистоном; все кислоты берут свое начало от «огненного воздуха».
В 1774 г. А. Лавуазье, проводя опыты с нагреванием оксида ртути, и горением фосфора, пришел к выводу, что в воздухе находится газ, поддерживающий горение. Он дал ему название «оксиген». Последнее определение постоянно трансформировалось в России в слово «кислород».
4.2.4 Открытие азота («мефитического воздуха»)
Дж. Пристли, хотя и получил кислород, но не понял его роли в процессах окисления металлов. Как сторонник теории флогистона, он ошибался, принимая кислород за воздух, от которого оксид ртути (II) отнял флогистон, превратившись в металл.
Но при этом процессе не весь «воздух» лишался флогистона, часть его оставалась в соединении. Эта часть «флогистированного воздуха» (азот) прочно удерживающая флогистон, также была известна Дж. Пристли. В 1772 г. он провел серию опытов, которые завершились открытием азота. Кислород – по Дж. Пристли – это дефлогистированный, то есть обыкновенный воздух минус флогистон, а азот – флогистированный воздух, то есть обыкновенный воздух плюс флогистон.
В 1772 г. Г. Кавендиш провел следующий опыт. Он пропустил обычный воздух над раскаленным углем и поглотил с помощью раствора щелочи углекислый газ. В остатке он получил «вид воздуха», который был несколько легче обычного и не поддерживал горения. Он назвал его «мефитическим» (или испорченным, вредным воздухом). Азот был получен также Дж. Пристли. Он назвал его «флогистированным» воздухом.
В 1778 г. Г. Кавендиш опубликовал последнюю работу по химии газов, в которой рассмотрел природу азота. При пропускании электрического разряда (в эвдиометре) через смесь воздуха и кислорода образовался оксид азота (IV), и он поглощался раствором щелочи. После поглощения избытка кислорода в опыте от взятого воздуха осталась 1/120 часть от всего первоначального объема.
Только через 110 лет Д. Рэлей и В. Рамзай обнаружили в этой части инертные газы.
Таким образом, благодаря работам Дж. Блэка, К. Шéеле, Дж. Пристли и Г. Кавендиша к концу XVIII века в химии прочно установилось положение: без учета массы газа нельзя составить баланс химической реакции. За 20 последующих лет удалось выделить около двадцати различных газов, изучить их свойства, установить качественный и количественный состав атмосферного воздуха.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2267; Нарушение авторских прав?; Мы поможем в написании вашей работы!