
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Разрешающей способности
|
|
|
|
Для решения этой задачи надо знать основные пути фрагментации основных классов органических соединений.
Таблица фрагментации органических соединений
| Класс соединений | І(М) | Основные направления фрагментации |
| Алканы | УМа) | В нормальных алканах (М - СН3)+, в разветвленных - преимущественно по месту разветвления, далее (А - 14)+ (уменьшение на СН2). Пики более стабильных ионов интенсивнее. |
| Алкены | СР | β-разрыв цепи, далее кяк в алканах |
| Арены АrCH2Rб) | В | Для незамещенных (М - С2Н2)+, для алкилзамещен- ных - разрыв боковой цепи: R+ та ArCH2+ |
| Галогенпроиз-водные RCH2CH2Xв) | Н | Разрыв слабой связи:RCH2CH2+ (J>Br>Cl>F); α-разрыв: RCH2+ и CH2X+(F>Cl>Br>J). Перегруппи- ровка: R-CH=CH2+ и HX+(F>Cl>Br>J). Изотопное расщепление сигналов: 79Br: 81Br = 1:1, 35Cl: 37Cl = 3:1. |
| Спирты,тиоспирты RCH2YH | ОН | α-разрыв: R+ та СН2=YН+, разрыв Y-Н(М-1). Пе- регруппировка: (М-Н2Y), где Y = O и S. |
| Простые эфиры RCH2-Y-CH2R’ г) | УМ | α-разрыв: (М-R)+, (М-R’)+, R+, R’+. Разрыв С-Y: RСН2+, R’СН2+, (М-СН2R)+, (М-СН2R’)+. |
 Эфиры и амиды
RCH2-CO-Y г)
R’CH2-CH2 Эфиры и амиды
RCH2-CO-Y г)
R’CH2-CH2
| ССР | α-разрыв: СОYСН2СН2R’+ и RСН2+, RСН2СºY+ и R’СН2СН2+. Перегруппировка: RСН2СОYН+ и R’-СН=СН2+. Перегруппировка: RY-СН2СН2R’+. |
| Альдегиды RCH2CH2CH2COН | СР | α-разрыв: (М-Н)+, (М-СНО)+, СНО+. Перегруппи- ровка: СН3СОН+ та R-СН=СН2+. |
| Кетоны R’CH2CH2CH2COR | СР | α-разрыв: (М-R)+, (М-CH2СН2СН2R’)+, R+, R’СН2СH2CH2+. Перегруппировка: СН3СОCН3+ и R’-СН=СН2+. |
| Кислоты RCOOH | УМ | α-разрыв: R+ и RСО+. Перегруппировка: RН+= (М-СО2)+. |
| Амины RCH2NH2, (RCH2)2NH д) | Н | α-разрыв: R+ та RСH2-NH=CH2+, для вторичных и третичных аминов преимущественно отщепляется большая цепь. |
а)Интенсивность: ОН – очень низкая, Н – низкая, УМ – умеренная, СР – средняя, В – высокая.
Продолжение сносок к таблице:





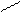

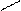



 б) ОН С5Н6+ + СО ОСН3 С6Н6+ +Н2СО NH2
б) ОН С5Н6+ + СО ОСН3 С6Н6+ +Н2СО NH2



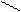




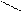

 ;; HCN + С5Н6+
;; HCN + С5Н6+


 С5Н5+ + НСО С6Н7+ + НСО
С5Н5+ + НСО С6Н7+ + НСО
в) Уменьшение в ряду J >Br >Cl >F.
г) Аналогичные направления фрагментации имеют место для тиоаналогов и амидов, где Y = O, S и NH или NCH2CH2R’.
д)Фрагментация: третичные > вторичные > первичные.

В общем случае способ решения задач по установлению строения органического вещества методами масс-спектрометрии очень сложный, при этом сложность возрастает с увеличением молекулярной массы соединения и усложнением самого масс-спектра. В принципе в настоящее время этот метод самостоятельно для решения структурных задач не используется, только в комплексе с другими физическими методами. Однако, он может дать много полезной информации для установления строения, и каждый химик должен иметь представление, как ее использовать. Далее предлагается наиболее простой вариант решения такой задачи при помощи анализа массовых чисел осколочных ионов (табл.3.4.) и нейтральных фрагментов, которые образуются при распаде ионов по уравнению (7.4) в лекции № 7.
Для наглядности методику решения поставленной задачи можно рассмотреть на конкретном примере. Например, надо установить строение органического соединения по его масс-спектру:
m/e (І) – 88(3), 87(53), 73(1), 72(12), 58(1), 56(1), 45(22), 44(100), 43(44), 42(20), 41(3), 40(20), 31(3), 30(11), 29(1).
Интенсивный пик с m/e = 87 можно отнести к молекулярному иону, что подтверждается наличием в спектре пика m/e = 72 = 87 – 15. Таким образом, соединение содержит нечетное число атомов азота, ибо его молекулярная масса нечетная. Слабый пик с m/e = 88 – изотопный. Его интенсивность:
87(М) – 100 %, ибо 53 – 100 %, х = 5,6.
88(М+1) – 5,6 % 3 – х
Ошибка определения интенсивности пика М+1 составляет около 15 % (0,5 от 3) от его величины (с точностью до 1), т.е. 5,6 ± 1. Поэтому, исходя из нее, при помощи таблицы Бейнона (табл. 3.2, полную таблицу см. в приложении А к разделу 2 работы [2]) нельзя однозначно определить молекулярную формулу. Можно только указать наиболее вероятные из них: С5Н13N, C4H9NO, C3H9N3, C3H5NO2.
Отбрасываем слабые пики фрагментарных ионов (І £ 3). Дальнейший анализ остальных фрагментарных пиков представлено в виде таблицы:
| m/e (І) | Формула катиона (М– Х)+ | Мх | Формула фрагмента Х |
| 72(12) | Должен быть нечетный азот, тогда (СН3)2N=С=О или изо-меры С4Н10N. Исходные фор-мулы: С4Н9NО или С5Н13N | СН3 | |
| 45(22) | Формула С2Н5О(СН3СНОН) не подходит, ибо не содержит азот, как и СООН. Тогда воз-можны 2 варианта: СН3NО и С2Н7N (табл.3.2). Подтвержде- но С4Н9NO или С5Н13N | С3Н6=СН3-СН=СН2 (признак перегруппировки Мак-Лафер-ти), СН2=С=О из ацетильного производного ХСОСН3. Фраг-мент не содержит азот, входя-щий, таким образом, в М - Х | |
 44(100) 44(100)
| СН3СОН, но суммарная фор-мула С3Н5NO2 молекулярного иона не соответствует пикам с m/e 72 и 45 Обязательно наличие азота, поэтому (СН3)2N или Н2NСО | НN=С=О, невозможно СН3СО, С3Н7 | |
 43(44) 43(44)
| С2Н5N не подходит СН3СО. Так как фрагмент Х получается только из амидов, тогда С5Н13N не походит. Правильно С4Н9NO | С3Н8 и С2Н4О не подходят, ибо получаются из соединений, не содержащих азот (алканов, аль-дегидов) С2Н6N = (СН3)2N, т.е. диметила- мид(но не этиламид). СОNН2 не подходит, ибо соединение не ароматично | |
| 42(20) | Должен содержать азот: N=С=О. С3Н6 не подходит, ибо не содержит азот | НNО2 не подходит, ибо не соот- ветствует пикам с m/e 72 и 45 (как и NО2, СО2Н и С2Н7О). Подходит 3СН3 при многоста-дийном распаде. | |
| 40(20) | СН2=С=N | ||
| 30(11) | NО, СН2NН2 |
Пик (М– Х)+ с m/e = 42 свидетельствует, что соединение обязательно содержит О, таким образом, единственно правильная формула - С4Н9NO. Это также согласуется и с пиком m/e = 43. Тогда приходим к выводу, что соединение распадается на фрагменты СН3СО и (СН3)2N, объединяя которые, получаем структуру СН3СО-N(СН3)2. Именно это соединение, претерпевая распад, характерный для кетонов, эфиров и амидов (см. табл. фрагментации), отщепляет группу СН3 или (СН3)2N и дает фрагментарные иони (СН3)2N=С=О+ и СН3СО+. То обстоятельство, что соединение отщепляет три группы СН3, свидетельствует, что оно не может быть этилацетамидом, те более, что в спектре ни среди фрагментарных ионов, ни среди фрагментов Х группа С2Н5 не встречается.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 432; Нарушение авторских прав?; Мы поможем в написании вашей работы!