
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементы теории горения
|
|
|
|
Под горением понимают процесс химического взаимодействия топлива и окислителя, при интенсивном выделении тепла, скачкообразном росте температур, концентрации продуктов горения и снижении концентрации окислителя. При горении происходит преобразование химической энергии топлива в тепловую энергию, идущую на нагрев продуктов сгорания.
Химические реакции, идущие с выделением тепла, называются экзотермическими.
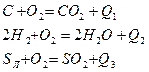
Химические реакции, идущие с поглощением тепла, называются эндотермическими.

Существуют и другие виды реакций:
1. гомогенные, если окислитель и топливо в одном агрегатном состоянии.
2. гетерогенные, если окислитель и топливо находятся в разных агрегатных состояниях.
При сжигании топлива, как правило, интенсивность экзотермических реакций выше, чем интенсивность эндотермических.
Интенсивность горения характеризуется скоростью химической реакции. Под скоростью гомогенной химической реакции понимают массовое количество вещества, которое реагирует в единицу объема, в единицу времени.
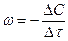
Считают, что скорость гомогенной реакции подчиняется закону действующих масс, т.е. пропорциональна произведению реагирующих веществ или масс.
 , где (1)
, где (1)
m и n – число молей реагирующего вещества, k – постоянная скорости горения.
Например:
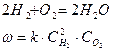
При данной температуре концентрация пропорциональна парциальному давлению соответствующего газа.
 (2)
(2)
При сжигании твердого топлива парциальное давление паров продуктов газификации, а следовательно и их концентрации есть величины постоянные при данной температуре.
 (3)
(3)
Константа скорости горения определяется по закону Аррениуса: 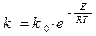
E –энергия активации;
R –газовая постоянная;
T–температура процесса в градусах °К.
Это выражение показывает, что в реакции участвуют не все молекулы топлива, а только молекулы, обладающие энергией активации, т.е. энергией, достаточной для разрушения внутренних связей.

Для того, чтобы сообщить топливу достаточное количество энергии его необходимо подогреть.
Рассмотрим влияние температуры на величину константу скорости горения. 
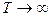


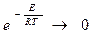
Таким образом, k показывает долю молекул, участвующих в процессе горения. k - характеристика полного числа столкновений молекул реагирующих веществ.
- характеристика полного числа столкновений молекул реагирующих веществ.
Горение твердого топлива
Различают два периода:
1. сушка при температуре около 100°С. Время сушки зависит от влажности, от размеров кусков, от условий теплообмена.
2. горение состоящее из следующих стадий:
а) выход летучих и образование нелетучего остатка;
б) горение летучих;
в) горение нелетучего коксового остатка.
Примерно 90% времени занимает горение коксового остатка (С).
Учитывают также, что при этом выделяется основное количество тепла. Горение твердого топлива в основном определяется механизмом и кинетикой горения углерода.
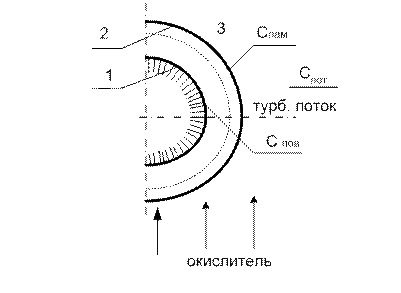
1. поверхность коксовой частицы
2. граница ламинарного слоя
3. турбулентный поток.
Данное горение протекает на поверхности и относится к гетерогенным реакциям: в этом процессе подводится кислород, который реагирует с частицами твердого топлива.
Скорость химической реакции зависит от скорости подвода кислорода к поверхности реагирования и от кинетики химической реакции.
Количество O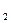 , подведенное в единицу времени можно определить.
, подведенное в единицу времени можно определить.
a) Поверхность ламинарного слоя
 , А – коэф. турбулентной диффузии. (4)
, А – коэф. турбулентной диффузии. (4)
b) Поверхность частиц:
 ,
, 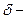 толщина ламинарного слоя. (5)
толщина ламинарного слоя. (5)
D – коэффициент молекулярной диффузии.
Совместное решение уравнений (4) и (5):
 (6)
(6)

 (7)
(7)
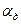 - константа скорости диффузии.
- константа скорости диффузии.
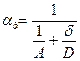
Таким образом, количество кислорода, подводимого к поверхности, является функцией:  . В свою очередь
. В свою очередь 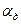 является функцией, зависящей от скорости обтекания, размера частицы и вязкости потока:
является функцией, зависящей от скорости обтекания, размера частицы и вязкости потока: 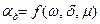 .
.
При установившемся процессе горения скорость процесса равна скорости подвода кислорода:
 (8)
(8)
С другой стороны, ранее получено, что скорость гетерогенного горения равна:
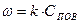 (9)
(9)
Совместное решение уравнений (8) и (9) дает выражение для скорости горения:
 (10)
(10)
 (11)
(11)
где  - приведенная константа скорости горения, представляющая из себя единицу, деленную на сопротивление процессу горения.
- приведенная константа скорости горения, представляющая из себя единицу, деленную на сопротивление процессу горения.
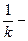 химическое (кинетическое) сопротивление;
химическое (кинетическое) сопротивление;
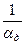 - диффузионное сопротивление;
- диффузионное сопротивление;
 - общее сопротивление.
- общее сопротивление.
В зависимости от соотношения этих сопротивлений, на которые влияют температура процесса, диаметр частиц, скорость обтекания и т.д., различают кинетическую и диффузионную области горения. Рассмотрим зависимость скорости процесса горения от температуры процесса и диаметра частиц (δ).


|
|

|
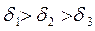

При низких температурах (t<1000°С), скорость процесса горения ограничивается кинетическим или химическим сопротивлением процесса горения. Определяющим фактором скорости процесса является температура. Область горения называется кинетической – (II).
В области (t>1400°C) скорость реакции горения ограничивается скоростью подвода кислорода. Данная область называется диффузионной (I)
В диапазоне температур 1000-14000С - область III на скорость влияют оба фактора (температура процесса горения и скорость подвода кислорода). Данная область называется промежуточной –(III).
Горение жидкого топлива
При горении жидкого топлива температура воспламенения и горения выше температуры кипения отдельных его фракций, поэтому жидкое топливо вначале испаряется, а затем сгорание паров смеси с воздухом происходит при одном агрегатном состоянии. Скорость горения определяется скоростью испарения капель мазута, которая зависит от качества распыла и от скорости подвода кислорода. Снижение диаметра капель ведет к увеличению поверхности испарения, повышению температуры процесса, усилению теплообмена. Горение паров жидкого топлива происходит в диффузионной области. При недостатке кислорода наблюдается термический крекинг, т.е. образование тяжелых углеводородов в виде мельчайших частиц углерода (сажи), что снижает полноту сгорания топлива.
Условия повышения интенсивности сжигания жидкого топлива:
1. предварительный подогрев;
2. тонкое распыливание;
3. подвод воздуха в ядро факела;
4. хорошие условия перемешивания;
5. поддерживание температуры в ядре факела выше 550°С.
Горение газового топлива
Установлено, что скорость протекания горения газового топлива значительно выше, чем по закону действующих масс и закону Аррениуса. В действительности реакции протекают не непосредственно между исходными веществами, а через ряд промежуточных стадий, в которых участвуют и исходные молекулы и активные осколки в виде O, H, OH, при этом энергия активации промежуточных стадий значительно ниже, а скорость протекания реакций выше.
Началу реакции предшествует период индукции или период зарождения активных частиц за счет разрушения части исходных молекул. Горение газового топлива происходит по законам цепных разветвленных реакций (ЦРР), открытых академиком Семёновым.
Согласно данной теории, превращение исходных веществ в конечные происходит через систему промежуточных звеньев, включающих:
1. зарождение цепи;
2. разветвление цепи (одна активная частица превращается в две или более активных частиц);
3. обрыв цепи.
Рассмотрим реакцию на примере горения водорода,
где М – активная молекула
 За один цикл из одного активного атома водорода образуется три активных атома водорода; после второго цикла – 9; после третьего – 27 (реакция лавинообразная).
За один цикл из одного активного атома водорода образуется три активных атома водорода; после второго цикла – 9; после третьего – 27 (реакция лавинообразная).
В реальных условиях часть активных атомов погибает. При этом в каждом сечении факела наблюдается установившийся процесс. Интенсивность сжигания газа определяется условиями смесеобразования.
лекция №7
Материальный баланс котла
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 533; Нарушение авторских прав?; Мы поможем в написании вашей работы!